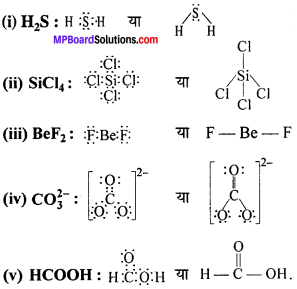
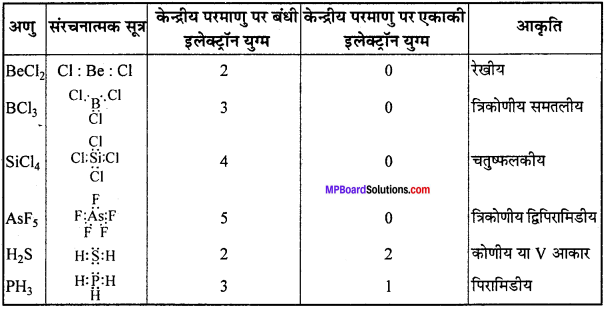
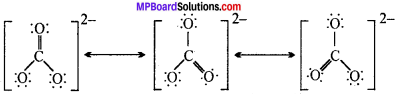
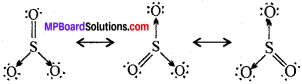
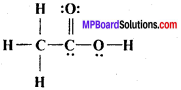
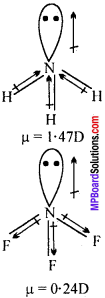
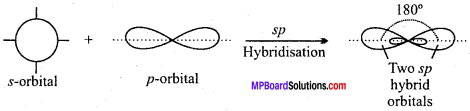
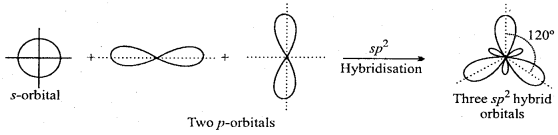
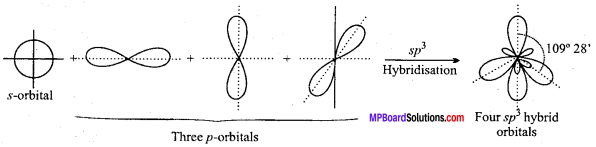
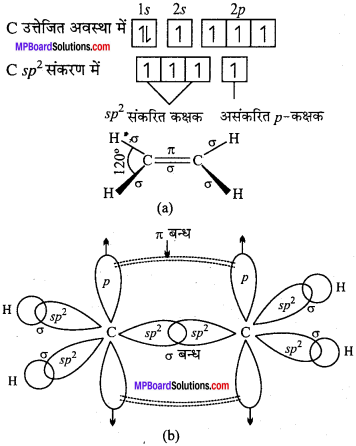
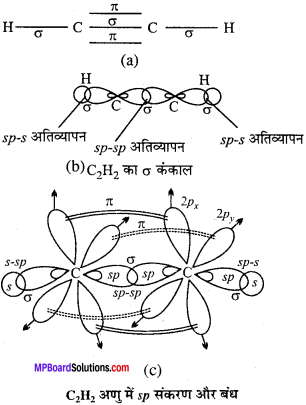
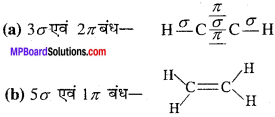
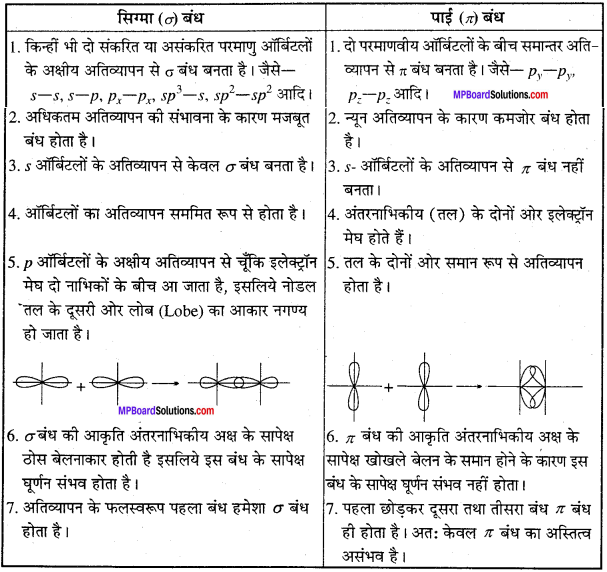
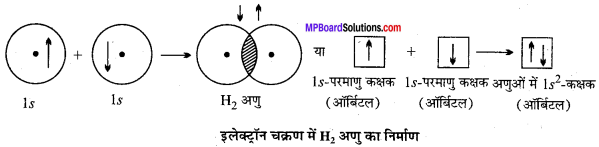
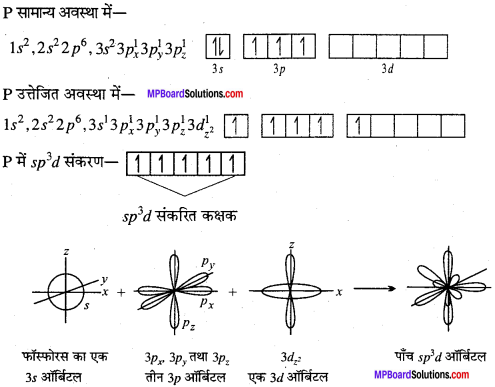
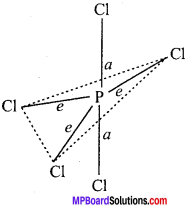
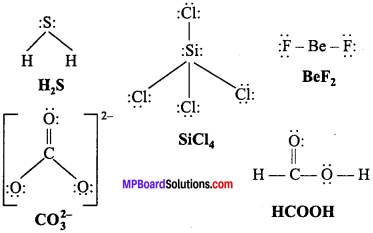
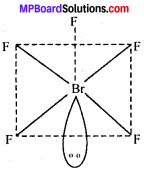
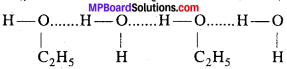
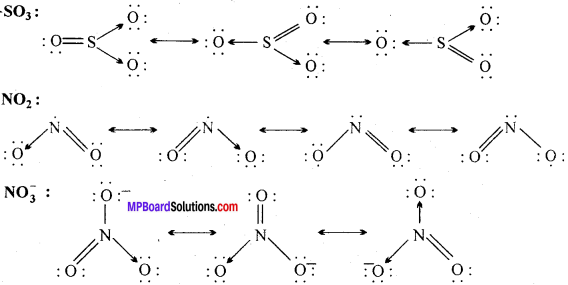
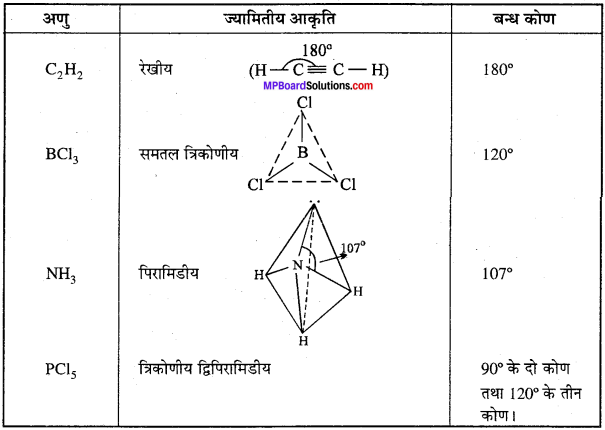
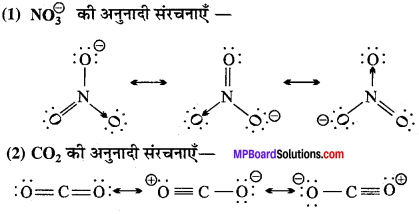
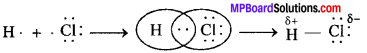
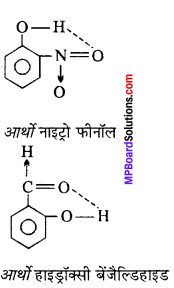
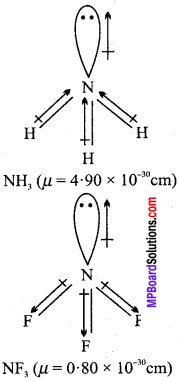
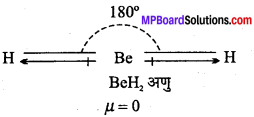
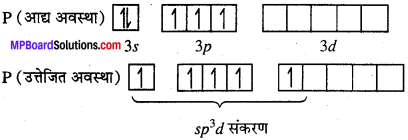
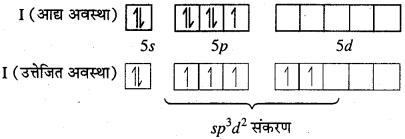
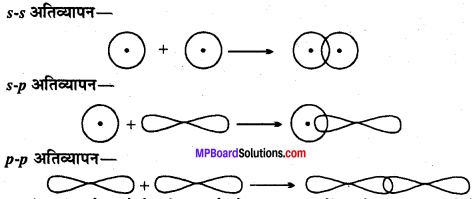
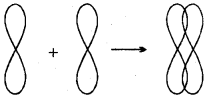
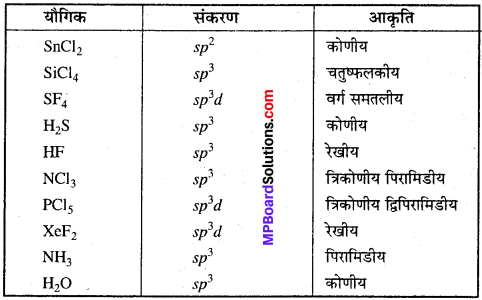
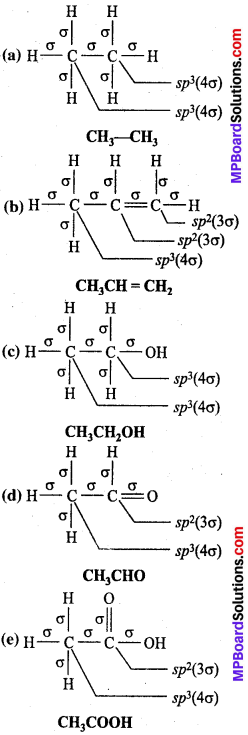
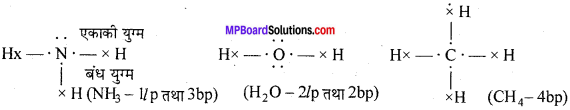
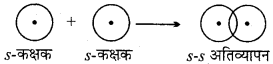
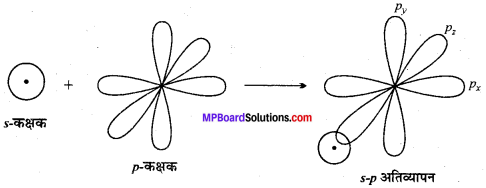
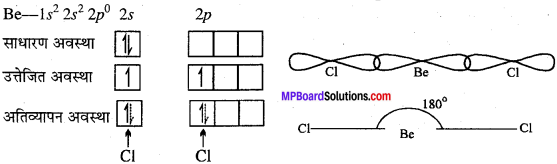
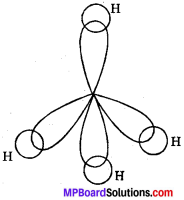
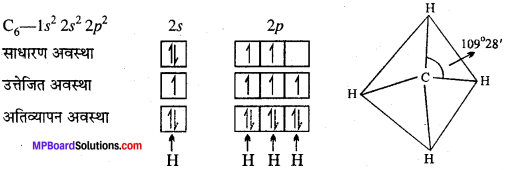
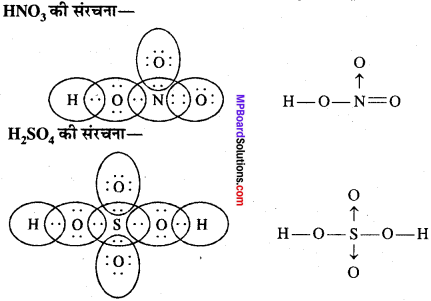
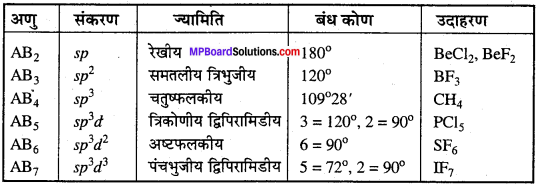
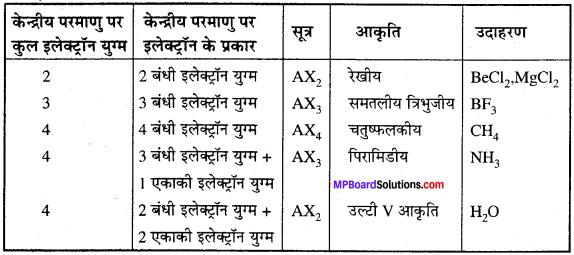
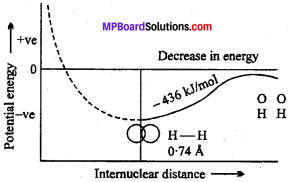
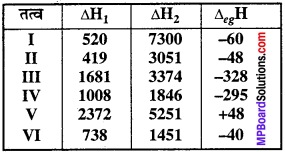
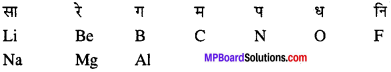
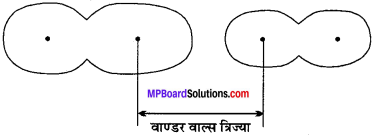
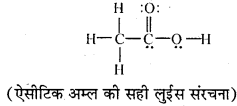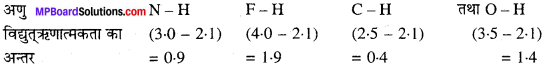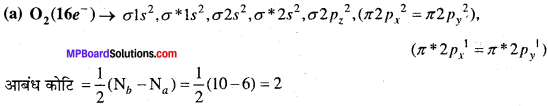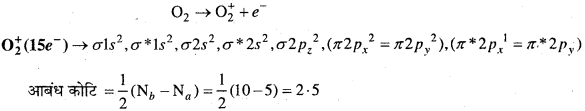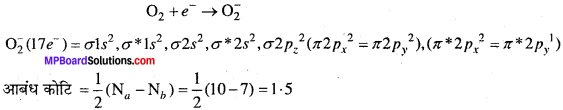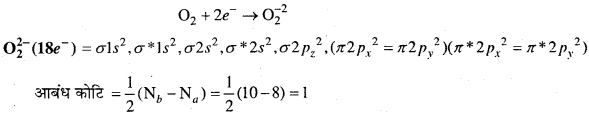MP Board Class 11th Chemistry Solutions Guide Pdf Free Download रसायन विज्ञान in both Hindi Medium and English Medium are part of MP Board Class 11th Solutions. Here we have given NCERT Madhya Pradesh Syllabus MP Board Class 12 Chemistry Book Solutions Rasayan Vigyan Pdf.
MP Board Class 11th Chemistry Book Solutions in Hindi Medium
- Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
- Chapter 2 परमाणु की संरचना
- Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
- Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
- Chapter 5 द्रव्य की अवस्थाएँ
- Chapter 6 ऊष्मागतिकी
- Chapter 7 साम्यावस्था
- Chapter 8 अपचयोपचय अभिक्रियाएँ
- Chapter 9 हाइड्रोजन
- Chapter 10 s-ब्लॉक तत्त्व
- Chapter 11 p-ब्लॉक तत्त्व
- Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें
- Chapter 13 हाइड्रोकार्बन
- Chapter 14 पर्यावरणीय रसायन
MP Board Class 11th Chemistry Book Solutions in English Medium
- Chapter 1 Some Basic Concepts of Chemistry
- Chapter 2 Structure of Atom
- Chapter 3 Classification of Elements and Periodicity in Properties
- Chapter 4 Chemical Bonding and Molecular Structure
- Chapter 5 States of Matter
- Chapter 6 Thermodynamics
- Chapter 7 Equilibrium
- Chapter 8 Redox Reactions
- Chapter 9 Hydrogen
- Chapter 10 The s-Block Elements
- Chapter 11 The p-Block Elements
- Chapter 12 Organic Chemistry: Some Basic Principles and Techniques
- Chapter 13 Hydrocarbons
- Chapter 14 Environmental Chemistry
We hope the given MP Board Class 11th Chemistry Solutions Guide Pdf Free Download रसायन विज्ञान in both Hindi Medium and English Medium will help you. If you have any query regarding NCERT Madhya Pradesh Syllabus MP Board Class 11 Chemistry Book Solutions Rasayan Vigyan Pdf, drop a comment below and we will get back to you at the earliest.