MP Board Class 11th Chemistry Solutions Chapter 5 द्रव्य की अवस्थाएँ
द्रव्य की अवस्थाएँ NCERT अभ्यास प्रश्न
प्रश्न 1.
30° से. तथा 1 bar दाब पर वायु 500 dm आयतन को 200 dm तक संपीडित करने के लिए कितने न्यूनतम दाब की आवश्यकता होगी?
हल:
स्थिर ताप बॉयल के नियमानुसार,
P1V1 = P2V2,
P1 = 1 bar
V1 = 500 dm3
P2=?
V2 = 200 dm3
\(\quad { P }_{ 2 }=\frac { { P }_{ 1 }{ V }_{ 1 } }{ { V }_{ 2 } } \)
=\(\frac { 1×500 }{ 200}\) = 2.5 bar.
प्रश्न 2.
35° से. ताप तथा 1 – 2 bar दाब पर 120 ml धारिता वाले पात्र में गैस की निश्चित मात्रा भरी है। यदि 35° से. पर गैस को 180 ml धारिता वाले फ्लास्क में स्थानांतरित किया जाता है, तो गैस का दाब क्या होगा?
हल:
दिया है – P1 = 1.2 bar,
V1 = 120 ml,
P2 = ?,
V2 = 180 ml
स्थिर ताप पर बॉयल के नियम से,
\(\quad { P }_{ 2 }=\frac { { P }_{ 1 }{ V }_{ 1 } }{ { V }_{ 2 } } \)
अतः P2 = \(\frac { 1.2 bar × 120mL }{ 180}\) = 0.8bar
प्रश्न 3.
अवस्था-समीकरण का उपयोग करते हुए स्पष्ट कीजिए कि दिए गए ताप पर गैस का घनत्व, गैस के दाब के समानुपाती होता है।
उत्तर:
आदर्श गैस समीकरण के अनुसार,
PV = nRT
P = \(\frac { nRT}{V}\)
![]()
= \(\frac { m}{M}\)
P = \(\frac { mRT}{MV}\)
अब घनत्व d=\(\frac { m}{V}\)M रखने पर,
P = \(\frac { dRT}{M}\)}
अतः स्थिर आयतन पर P α d होगा।
प्रश्न 4.
0°C पर तथा 2 bar दाब पर किसी गैस के ऑक्साइड पर घनत्व 5 bar दाब पर डाइनाइट्रोजन के घनत्व के समान है, तो ऑक्साइड का अणु-भार क्या है ?
हल:
घनत्व d = \(\frac { MP}{RT}\), (यहाँ R और T किसी गैस के लिए स्थिरांक है)
N2 के लिए P=5 bar एवं M = 28 g mol-1
dN2 = \(\frac { PM}{RT}\) = \(\frac {5 × 28}{RT}\)
दिये गये गैसीय ऑक्साइड के लिए P = 2 bar एवं M = ?
doxide = \(\frac { PM}{RT}\) = \(\frac {5 × 28}{RT}\)
प्रश्नानुसार, dN2 = doxide
5 × 28 = 2× M
M= \(\frac {5 × 28}{2}\) = 70g mol-1
![]()
प्रश्न 5.
27° से. पर एक ग्राम आदर्श गैस का दाब 2 bar है।जब समान ताप एवंदाब पर इसमें दो ग्राम आदर्श गैस मिलाई जाती है, तो दाब 3 bar हो जाता है। इन गैसों के अणु-भार में संबंध स्थापित कीजिए।
हल:
PV = nRT
गैस A के लिए, PAV = NART ………..(i)
इसी प्रकार, गैस B के लिए, PBV = NBRT ………..(ii)
गैस A के मोलों की संख्या, nA = \(\frac { 1 }{ { M }_{ A } } \) [MA = A का मोलर द्रव्यमान]
गैस B के मोलों की संख्या, nB = \(\frac { 2 }{ { M }_{ B } } \) [MB = B का मोलर द्रव्यमान]
गैस A का दाब, PA = 2 bar
कुल दाब, Pकुल = PA + PB = 3 bar
गैस B का दाब,
PB= Pकुल – PA = 3 – 2 = 1 bar
V, R तथा T दोनों गैसों के लिए समान है।
अतः समी. (i) तथा (ii) से,
\(\frac { { P }_{ A } }{ { P }_{ B } } \) = \(\frac { { n }_{ A } }{ { n }_{ B } } \) = \(\frac { { 1×M }_{ B } }{ { { M }_{ A } }×2 } \)
= \(\frac { { M }_{ B } }{ { M }_{ A } } \) = \(\frac { { 2P }_{ A } }{ { P }_{ B } } \)
= \(\frac { { M }_{ B } }{ { M }_{ A } } \) = \(\frac { 2×2 }{ 1 }\)
MB = 4MA
प्रश्न 6.
नाली साफ करने वाले ड्रेनेक्स में सूक्ष्म मात्रा में ऐल्युमिनियम होता है। यह कास्टिक सोडा से क्रिया कर डाइहाइड्रोजन गैस देता है। यदि 1 bar तथा 20°C ताप पर 0.15 ग्राम ऐल्युमिनियम अभिक्रिया करेगा, तो निर्गमित डाइहाइड्रोजन का आयतन क्या होगा?
हल:
प्रयुक्त रासायनिक समीकरण –
2 AI (2 मोल) + 2NaOH + 2H2O → 2NaAlO2 + 3H2(3 मोल)
= 54 gm
अत: 0-15 g AI से उत्पन्न होने वाले H2 मोल =\(\frac { 3 }{ 54 }\) × 0.15 = 8333×10-3 mol
PV = nRT में P= 1 bar, V = ?, n=8.333 × 10-mol, R=0.083 L atm mol-1K-1 T = 293K रखने पर,
1 × V = 8.33 x 10-3× 0.083 × 293
V=0.202 L या 202 mL.
प्रश्न 7.
यदि 27°C पर 9 dm3 धारिता वाले फ्लास्क में 3.2 ग्राम मेथेन तथा 4.4 ग्राम कार्बन डाइऑक्साइड का मिश्रण हो, तो इसका दाब क्या होगा?
हल:
समीकरण, PV = \(\frac {m }{ M}\)RT
मेथेन का दाब –
m = 3.2g, M = 16g mol-1 , T = 300K, V = 9 × 10-3 m-3 R = 8.314 Pa m3K-1mol-1
![]()
CO2 का दाब, –
w = 4.4g, M = 44g mol-1, T = 300K, V = 9x 10-3m3, R= 8.314 Pa m3K-1mol-1 Pa
![]()
मिश्रण का कुल दाब = \({ P }_{ { CH }_{ 4 } }\) + \({ P }_{ { CO }_{2} }\)
= 5-543 × 104Pa + 2.771 × 104 Pa
= 8:314 × 104 Pa.
प्रश्न 8.
27°C ताप पर जब 1 लीटर के फ्लास्क में 0.7 bar पर 2.0 लीटर डाइऑक्सीजन तथा 0.8 bar पर 0.5 L डाइहाइड्रोजन को भरा जाता है, तो गैसीय मिश्रण का दाब क्या होगा?
हल:
समी. P1V1+ P2V2 = P3V3 में,
P1 = 0.8 bar, P2 = 0.7 bar, V1 = 0.5L, V2 = 2L, P3 = ?, V3= 1L रखने पर,
0.8 x 0.5 + 0.7 × 2 = P3 × 1.
∴ P3 = 1.8 bar.
प्रश्न 9.
यदि 27°C ताप तथा 2 bar दाब पर एक गैस का घनत्व 5.46 gdm’ है, तो STP पर इसका घनत्व क्या होगा?
हल:
दी गई गैस के लिए,
\(\frac { { P }_{ 1 } }{ { d }_{ 1 }{ T }_{ 1 } } =\frac { { P }_{ 2 } }{ { d }_{ 2 }T_{ 2 } } \)
d1= 5.46 g/dm3, d2 = ?, P2 = 1 bar, P1 = 2 bar, T1 = 27 + 273 = 300K, T1 = 273 K
∴ \(\frac { 2 }{ 15.46×300 } =\quad \frac { 1 }{ d_{ 2 }×274 } \)
या d2 = 3 g/dm3.
प्रश्न 10.
यदि 546°C तथा 0.1 bar दाब पर 34.05 ml फॉस्फोरस वाष्प का भार 0.0625 g है, तो फॉस्फोरस का मोलर द्रव्यमान क्या होगा?
हल:
PV = nRT
PV = \(\frac { mRT }{ M }\)
(m = फॉस्फोरस का द्रव्यमान (g) तथा M = फॉस्फोरस का मोलर द्रव्यमान)
या M=\(\frac { mRT }{PV}\)
![]()
M = 1250.4g mol-1.
![]()
प्रश्न 11.
एक विद्यार्थी 27°C पर गोल पेंदे के फ्लास्क में अभिक्रिया-मिश्रण डालना भूल गया तथा उस फ्लास्क को ज्वाला पर रख दिया। कुछ समय पश्चात् उसे अपनी भूल का अहसास हुआ। उसने उत्तापमापी की सहायता से फ्लास्क का ताप 477°C पाया।आप बताइए कि वायु का कितना भाग फ्लास्क से बाहर निकला।
हल:
प्रथम विधि –
माना 27°C (T1 = 300K) पर फ्लास्क में हवा का आयतन = Vcm3
प्रश्नानुसार, V1 = Vcm3, V2 = ?, T1= 300K, T2 = 750K
\(\frac { { V }_{ 1 } }{ { T }_{ 1 } } =\quad \frac { { V }_{ 2 } }{ { T }_{ 2 } } \)
\(\frac { V }{ 300 } =\frac { { V }_{ 2 } }{ 750 } \quad \)
⇒ 300V2 = 750V (कुल आयतन)
∴ V2 = 2.5V
बाहर निकला आयतन = 2.5V-V = 1.5V
बाहर निकली वायु का भाग = \(\frac { 1.5V }{ 2.5V }\)= 0.6
द्वितीय विधि –
PV = nRT
nα\(\frac { 1 }{ T }\).
\(\frac { { n }_{ 1 } }{ { n }_{ 2 } } =\frac { T_{ 1 } }{ { T }_{ 2 } } \quad \) = \(\frac { 300 }{ 750 }\).
\(\frac { { n }_{ 1 } }{ { n }_{ 2 } } \) = 0.4
∴ बाहर निकली वायु का भाग = 0.6.
प्रश्न 12.
3.32 bar पर 5 dm3 आयतन घेरने वाली 4.0 mol गैस के ताप की गणना कीजिए। (R = 0.83 bar dm3 mol-1 )
हल:
प्रश्नानुसार, P= 3.32 bar
आयतन, V= 5 dm3
मोलों की संख्या, n = 4 mol
गैस का नियतांक, R= 0.083 bar dm3 K-1 mol
ताप, T = ?
आदर्श गैस का समीकरण, PV = nRT से
![]()
T= 50K.
प्रश्न 13.
1.4 g डाइनाइट्रोजन गैस में उपस्थित कुल इलेक्ट्रॉनों की संख्या की गणना कीजिए।
हल:
∴ N2 के मोलों की संख्या =\(\frac { m }{ M }\) = \(\frac { 1.4 }{ 28 }\)=0.05
अणुओं की संख्या = 0.05 × 6.02 × 1023 = 3.01 x 1023
अणु नाइट्रोजन के एक अणु में 14 इलेक्ट्रॉन होते हैं।
अतः कुल इलेक्ट्रॉनों की संख्या = 14 × 3.01 × 1023 = 42.14 × 1022
प्रश्न 14.
यदि एक सेकंड में 1010 गेहूँ के दाने वितरित किए जाएँ, तो ऐवोगैड्रो-संख्या के बराबर दाने वितरित करने में कितना समय लगेगा?
हल:

प्रश्न 15.
27°C ताप पर 1 dm3 आयतन वाले फ्लास्क में 8 ग्राम डाइऑक्सीजन तथा 4 ग्राम डाइहाइड्रोजन के मिश्रण का कुल दाब कितना होगा?
हल:

H2 के मोलों की संख्या, \(\qquad { n }_{ { H }_{ 2 } }=\quad \frac { 4 }{ 2 } \) = 2.0mol
कुल मोलों की संख्या = 0.25 + 2.0 = 2.25 mol
प्रश्नानुसार, P = ?, n = 2-25 mol, V = 1 dm3, R = 0.083 bar dm K-1 mol-1
T= 27°C = 273 + 27 = 300K
अतः PV = nRT से,
दाब, P=\(\frac { nRT }{ V } \)
![]()
P = 56.025 bar.
![]()
प्रश्न 16.
गुब्बारे के भार तथा विस्थापित वायु के भार के अंतर को ‘पेलोड’ कहते हैं। यदि 27°C पर 10 m त्रिज्या वाले गुब्बारे में 1.66 bar पर 100kg हीलियम भरी जाए, तो पेलोड की गणना कीजिए। (वायु का घनत्व = 1.2 kg m’ तथा R = 0.083 bar dm3 K-1mol-1)
हल:
प्रथम गणना-विस्थापित वायु के भार के लिए
गुब्बारे की त्रिज्या (r) = 10 m, d = 1.2 kg m-3
गुब्बारे का आयतन (V) = \(\frac { 4 }{ 3 }\) πr3 = \(\frac { 4 }{ 3 }\) × \(\frac { 22 }{ 7 }\) × = (10)3
= 4190.5 m3
अतः विस्थापित वायु का भार = गुब्बारे की वायु का आयतन × वायु का घनत्व
= 4190.5 × 1-2 = 5028.6 kg
द्वितीय गणना – गुब्बारे में भरी He का द्रव्यमान
He के मोलों की संख्या (n) = \(\frac { PV }{RT }\).
∴ P = 1.66 bar, V = 4190.5 × 103 dm3, R = 0.083 bar dm3 K-1‘mol-1, T = 300K
![]()
= 279.37 ×103
अतः भरे गुब्बारे का भार = 100 + 1117.48 = 1217.48 kg
तृतीय गणना – पेलोड का भार = विस्थापित द्रव्यमान-भरे गुब्बारे का भार
= 5028.6 – 1217.8
= 3811.8 kg.
प्रश्न 17.
31.1 C तथा 1 bar दाब पर 8.8 ग्राम CO2 द्वारा घेरे गए आयतन की गणना कीजिए। (R = 0.083 bar L mol-1)
हल:
सूत्र,
PV = nRT से,
PV = \(\frac { m }{ M }\)RT
प्रश्नानुसार, P= 1 bar, V = ?, m = 8.8g. M= 44g mol-1 (CO2)
R = 0.083 bar LK-1 mol-1 तथा T= 31.1°C = 273 + 31.1
= 304.1 K
t =-273°C पर,
vt = v0 [1-\(\frac { 273 }{ 273 }\)] = 0
अर्थात् – 273°C पर गैस का आयतन शून्य हो जायेगा तथा गैसों का अस्तित्व समाप्त हो जायेगा।
8.8 g CO2द्वारा घेरा गया आयतन,
![]()
V=5.048 L.
प्रश्न 18.
समानदाब पर किसी गैस के 2.9g द्रव्यमान का 95°C तथा 0.184g डाइहाइड्रोजन का 17°C का आयतन समान है। बताइए कि गैसों का मोलर द्रव्यमान क्या होगा?
हल:
समी. PV=\(\frac { m }{Ml }\)RT
गैस के लिए, m = 2.9, T = 273 + 95 = 368K, M = ?
PV = \(\frac { 2.9 }{M }\) × R × 368 ………….(i)
एवं हाइड्रोजन के लिए, m = 0.184g, T = 273 + 17 = 290, M = 2
PV = \(\frac { 0.184 }{ 2}\) × R × 290 ………….(ii)
समी. (i) एवं (ii) से,
\(\frac { 2.9 }{M }\) × R × 368 = \(\frac { 0.184 }{ 2}\) × R × 290
![]()
प्रश्न 19.
एक bar दाब पर डाइहाइड्रोजन तथा डाइऑक्सीजन के मिश्रण में 20% डाइहाइड्रोजन (भार से) रखा जाता है, तो डाइहाइड्रोजन का आंशिक दाब क्या होगा?
हल:
∴ H2 तथा O2 के मिश्रण में भारानुसार 20% H2 है।
अतः WH2 = 20 g एवं WO2 = 80g
nH2 = \(\frac {20 }{ 2}\) = 10 moles
WO2 = \(\frac {80 }{ 32}\) = 2.5 moles
PH2= XH2 × Ptotla,
PH2 = \(\frac {10 }{ 10 + 2.5}\) × 1 = 0.8bar
Ptotla = 1bar
प्रश्न 20.
PV2T2/n राशि के लिए SI इकाई क्या होगी?
उत्तर:
![]()
![]()
प्रश्न 21.
चार्ल्स के नियम के आधार पर समझाइए कि न्यूनतम संभव ताप -273°C होता है।
उत्तर:
चार्ल्स के नियमानुसार,
Vt = V0(1+\(\frac {t}{ 273}\))
प्रश्न 22.
कार्बन डाइऑक्साइड तथा मेथेन का क्रांतिक ताप क्रमशः 31.1°C एवं -81.9°C है। इनमें से किसमें प्रबल अंतर आण्विक बल है तथा क्यों ?
उत्तर:
क्रान्तिक ताप का मान उच्च होने पर गैसों को द्रवित करना आसान होता है अर्थात् उनके अणुओं के मध्य अन्तर आण्विक बल उतना ही प्रबल होता है। चूँकि CO2 का क्रान्तिक ताप CH4 से उच्च है अत: CO2 में अन्तर आण्विक आकर्षण बल का मान CH4 से प्रबल होगा।
प्रश्न 23.
वाण्डर वाल्स प्राचल की भौतिक सार्थकता को समझाइए।
उत्तर:
वाण्डर वाल स्थिरांक ‘a’ का मान गैस के अणुओं के अन्तराणुक बल को दर्शाता है जबकि स्थिरांक ‘b’ गैस के अणुओं का प्रभावी आयतन है। ‘a’ और ‘b’ के उच्च मान होने पर गैस को द्रवित करना आसान होता है।
![]()
द्रव्य की अवस्थाएँ अन्य महत्वपूर्ण प्रश्न
द्रव्य की अवस्थाएँ वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सही विकल्प चुनकर लिखिए –
प्रश्न 1.
गैस के घनत्व और विसरण की दर के बीच सम्बन्ध स्थापित किया था –
(a) बॉयल ने
(b) चार्ल्स ने
(c) ग्राम ने
(d) ऐवोगैड्रो ने।
उत्तर:
(c) ग्राम ने
प्रश्न 2.
R का कैलोरी में लगभग मान है –
(a) 1
(b) 2
(c) 3
(d) 4. 3.
उत्तर:
(b) 2
प्रश्न 3.
परम ताप है –
(a) 0°C
(b) -100°C
(c) -273°C
(d) -373°C.
उत्तर:
(c) -273°C
प्रश्न 4.
गैसों का सामान्य समीकरण प्राप्त करने के लिये किन दो नियमों को संयुक्त किया गया है –
(a) चार्ल्स का नियम और डॉल्टन का नियम
(b) ग्राम का नियम और डॉल्टन का नियम
(c) बॉयल का नियम और चार्ल्स का नियम
(d) ऐवोगैड्रो का नियम और डॉल्टन का नियम।
उत्तर:
(c) बॉयल का नियम और चार्ल्स का नियम
![]()
प्रश्न 5.
स्थिर आयतन पर एक-अणुक गैस का दाब निर्भर करता है –
(a) पात्र की दीवार की मोटाई पर
(b) परम ताप पर
(c) तत्व के परमाणु-क्रमांक पर
(d) संयोजकता इलेक्ट्रॉनों की संख्या पर।
उत्तर:
(b) परम ताप पर
प्रश्न 6.
वास्तविक गैसों का व्यवहार आदर्श गैस के व्यवहार के अधिक समीप होता है यदि –
(a) ताप कम हो
(b) दाब अधिक हो
(c) दाब कम तथा ताप अधिक हो
(d) गैस मोनोएटॉमिक हो।
उत्तर:
(c) दाब कम तथा ताप अधिक हो
प्रश्न 7.
अधिक ऊँचे स्थानों पर जल कम ताप पर उबलने लगता है क्योंकि –
(a) वहाँ पर वायुमण्डलीय दाब कम होता है
(b) वहाँ पर वायुमण्डलीय दाब अधिक होता है
(c) अधिक ऊँचाई पर जल का हाइड्रोजन बन्ध अधिक प्रबल हो जाता है
(d) जल-वाष्प, जल-द्रव से हल्का होता है।
उत्तर:
(a) वहाँ पर वायुमण्डलीय दाब कम होता है
प्रश्न 8.
दो गैसों A तथा B के आण्विक द्रव्यमान क्रमशः 16 और 64 हैं। A और B के विसरण की दरों का अनुपात होगा
(a) 1:4
(b) 4 : 1
(c) 2 : 1
(d) 1 : 2.
उत्तर:
(c) 2 : 1
प्रश्न 9.
उच्च दाब पर गैसें आदर्श व्यवहार से विचलित हो जाती हैं क्योंकि –
(a) उच्च दाब पर अणुओं के संघट्टों (Collisions) की संख्या बढ़ जाती है
(b) उच्च दाब पर अणुओं के मध्य आकर्षण बढ़ जाता है
(c) उच्च दाब पर अणुओं का आकार छोटा हो जाता है
(d) उच्च दाब पर अणु स्थिर हो जाते हैं।
उत्तर:
(b) उच्च दाब पर अणुओं के मध्य आकर्षण बढ़ जाता है
प्रश्न 10.
एक गैस X की तुलना में मेथेन की विसरण की दर दुगुनी है।x का अणु भार है’ –
(a) 64
(b) 32.0
(c) 4.0
(d) 8.0.
उत्तर:
(a) 64
![]()
प्रश्न 11.
वाण्डर वॉल्स समीकरण का वह पद जो वास्तविक गैसों के अन्तराणुक बल का निरूपण करता है –
(a) (V-b)
(b) RT
(c) (P + \(\frac { a }{ { v }^{ 2 } } \))
(d) (RT)-1.
उत्तर:
(c) (P + \(\frac { a }{ { v }^{ 2 } } \))
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिये –
- गैसों के अणुगतिक सिद्धान्त के अनुसार किसी गैस की औसत गतिज ऊर्जा उसके …………. ताप के समानुपाती होती है।
- किसी गैस के एक मोल की गतिज ऊर्जा ………….. के बराबर होती है।
- वर्ग माध्य मूल वेग होता है ………………।
- औसत वेग = …………. x ………………. के बराबर होता है।
- अणुगतिक समीकरण का सूत्र है …………….।
उत्तर:
- परम
- 3/2 RT,
- \(\sqrt { \frac { 3PV }{ m } } \) या \(\sqrt { \frac { 3RT }{ m } } \)
- 0.921, वर्ग माध्य मूल वेग,
- PV = \(\frac { 1 }{ 3 }\) mnv2
![]()
प्रश्न 3.
उचित संबंध जोडिए –

उत्तर:
- (f) आयनिक क्रिस्टल
- (a) आणविक क्रिस्टल
- (b) सहसंयोजी क्रिस्टल
- (e) अक्रिस्टलीय क्रिस्टल
- (d) आणविक क्रिस्टल
- (c) धात्विक क्रिस्टल
प्रश्न 4.
एक शब्द / वाक्य में उत्तर दीजिए –
- किसी द्रव के बहाव में उत्पन्न प्रतिरोध को क्या कहते हैं?
- पृष्ठ तनाव का मात्रक है।
- दाब का SI मात्रक लिखिए।
- गैस के घनत्व एवं विसरण दर के बीच सम्बन्ध दर्शाने वाले वैज्ञानिक का नाम है।
- SI इकाई में गैस स्थिरांक का मान होता है।
- 1 पास्कल का मान बराबर होता है।
उत्तर:
- श्यानता
- डाइन प्रति सेमी
- पास्कल
- ग्राम
- 8.314 JK-1 mo-1
- 1Nm2
![]()
द्रव्य की अवस्थाएँ अति लघु उत्तरीय प्रश्न
प्रश्न 1.
किसी गैस का दाब किसे कहते हैं ?
उत्तर:
गैस को जिस पात्र में रखा जाता है, उसके अणु पात्र की दीवार से टकराते हैं। इस टकराव के कारण गैस पात्र की दीवार पर दाब उत्पन्न करते हैं, “प्रति इकाई क्षेत्रफल पर कार्य करने वाला बल दाब कहलाता है।”
![]()
दाब का S.I. मात्रक न्यूटन/वर्ग मीटर है, इसे पास्कल भी कहते हैं।
प्रश्न 2.
वायुमण्डलीय दाब से क्या समझते हो?
उत्तर:
पृथ्वी के चारों ओर वायु का लगभग 800 km मोटाई का आवरण है। यह वायु पृथ्वी के गुरुत्वाकर्षण बल के कारण पृथ्वी की सतह की ओर खिंचती है जिसके कारण पृथ्वी की सतह पर एक दाब उत्पन्न होता है जिसे वायुमण्डलीय दाब कहते हैं तथा एक वायुमण्डलीय दाब उस दाब के बराबर होता है। 760 mm पारा 0°C तथा मानक गुरुत्व जनित्र त्वरण पर डालता है।
प्रश्न 3.
अक्रिस्टलीय ठोस किसे कहते हैं ?
उत्तर:
वे ठोस जिनमें अवयवी कणों की कोई क्रमबद्ध संरचना नहीं होती इसलिये इनकी कोई एक निश्चित ज्यामिति संरचना नहीं होती है। इन्हें अक्रिस्टलीय ठोस कहते हैं। इन्हें आभासी ठोस भी कहते हैं। ये वास्तव में अतिशीतित द्रव होते हैं।
प्रश्न 4.
आयनिक क्रिस्टल किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
वे क्रिस्टलीय ठोस जिनमें अवयवी कण धनावेशित तथा ऋणावेशित आयन होते हैं। ये आयन संपूर्ण क्रिस्टल में निश्चित क्रम में व्यवस्थित होते हैं तथा इन आयनों के मध्य प्रबल स्थिर वैद्युत आकर्षण बल होता है। उदाहरण-Li, NaCl, ZnS इत्यादि।
प्रश्न 5.
सहसंयोजी क्रिस्टल को उदाहरण सहित समझाइये।
उत्तर:
वे क्रिस्टलीय ठोस जिनमें अवयवी कण परमाणु होते हैं तथा आपस में सहसंयोजी बंध द्वारा जुड़े रहते हैं। ये विद्युत् के कुचालक होते हैं तथा इनके गलनांक तथा क्वथनांक उच्च होते हैं। उदाहरण-डायमंड, सिलिका, सिलिकॉन कार्बाइड।
![]()
प्रश्न 6.
आण्विक क्रिस्टल किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
इनमें अवयवी कण अणु होते हैं। इनके मध्य दुर्बल वाण्डर वाल्स आकर्षण बल होता है। इनके mm.p. तथा b.p. निम्न होते हैं, ये क्रिस्टल नर्म होते हैं। उदाहरण-शुष्क बर्फ, बर्फ, आयोडीन।
प्रश्न 7.
गैसों के अणुगतिक सिद्धांत के एक अभिगृहित के अनुसार, ‘गैस के अणुओं के मध्य कोई आकर्षण बल नहीं होता है।’ यह कथन कितना सत्य है ? क्या आदर्श गैस को द्रवीकृत करना सम्भव है ? व्याख्या कीजिए।
उत्तर:
यह कथन केवल आदर्श गैसों के लिए सत्य है। किसी आदर्श गैस को द्रवीकृत करना सम्भव नहीं है क्योंकि आदर्श गैस के अणुओं के बीच अंतर-आण्विक आकर्षण बल नहीं पाया जाता है।
प्रश्न 8.
धात्विक क्रिस्टल को उदाहरण सहित समझाइये।
उत्तर:
इनमें अवयवी कण धनात्मक धात्विक आयन होते हैं। ये धातु आयन गतिशील इलेक्ट्रॉनों के मंडल में बिखरे रहते हैं तथा अवयवी कणों के मध्य धात्विक बंध होता है। ये विद्युत् के सुचालक होते हैं तथा इनके घनत्व उच्च होते हैं। उदाहरण-Cu, Zn, Fe, Ni इत्यादि।
प्रश्न 9.
विषम दैशिकता तथा सम दैशिकता किसे कहते हैं ?
उत्तर:
क्रिस्टलीय ठोस में विभिन्न दिशाओं में उनके भौतिक गुण जैसे-विद्युत् चालकता, अपवर्तनांक, तापीय प्रसार आदि में अंतर होता है, ऐसे पदार्थ विषम दैशिक कहलाते हैं तथा इस गुण को विषम दैशिकता कहते हैं। इसके विपरीत अक्रिस्टलीय ठोस में सभी दिशाओं में उनके भौतिक गुणों में समानता होती है, ऐसे पदार्थ सम दैशिक कहलाते हैं तथा इस गुण को सम दैशिकता कहते हैं।
प्रश्न 10.
परम शून्य ताप की परिभाषा लिखकर इसका मान सेन्टीग्रेड पैमाने पर बताइये।
उत्तर:
वह काल्पनिक ताप जिस पर किसी गैस का आयतन शून्य हो जाता है, परम शून्य ताप कहलाता है। सेन्टीग्रेड पैमाने पर यह मान -273°C होता है। इस शून्य से जो ताप नापा जाता है उसे परम ताप कहते हैं, इसे केल्विन से दर्शाया जाता है। 0°C = 273 K 0°C ताप को परम ताप में बदलने के लिये उसमें 273 जोड़ दिया जाता है।
![]()
प्रश्न 11.
क्रिस्टल की इकाई कोशिका से आपका क्या अभिप्राय है?
उत्तर:
किसी क्रिस्टल में उसके संघटक कणों जैसे-परमाणु, अणु या आयनों के क्रमबद्ध रूप से व्यवस्थित रहने पर जो सूक्ष्मतम इकाई बनती है। उसे क्रिस्टल की इकाई कोशिका या Unit cell कहते हैं।
प्रश्न 12.
क्रिस्टल जालक क्या है ?
उत्तर:
किसी क्रिस्टल की वह ज्यामिति जिसमें इकाई कोशिकाएँ क्रमबद्ध रूप से व्यवस्थित होकर एक बड़ी तथा इकाई कोशिका की आकृति के समरूप क्रिस्टल बनाती हैं तो उसे क्रिस्टल जालक कहते हैं।
प्रश्न 13.
मौसम अध्ययन के लिये छोड़े गये गुब्बारे के ऊपर उठने पर उसका आयतन कैसे बदलता है?
उत्तर:
गुब्बारा जैसे-जैसे ऊपर उठता है वायुमण्डलीय दाब में कमी आती है। लेकिन दाब घटने से गुब्बारे के अंदर का दाब अधिक हो जाता है जिससे उसका आयतन बढ़ने लगता है।
प्रश्न 14.
शीत ऋतु में झील में बर्फ की पर्त जम जाती है लेकिन उसमें उपस्थित मछली तथा जीवजन्तु जीवित रहते हैं, क्यों?
उत्तर:
जल का अधिकतम घनत्व 4°C ताप पर होता है किन्तु 4°C से कम ताप पर घनत्व कम होता है। जब झील का ताप गिरता है तो ऊपर के पृष्ठ का जल अधिक सघन हो जाता है और वह नीचे चला जाता है। यह क्रम तब तक चलता रहता है जब तक कि ताप 4°C तक नहीं पहुँच जाता है। पृष्ठ का ताप यदि 4°C से कम हो तो जल ऊपर की सतह पर ही रहता है और धीरे-धीरे बर्फ में बदल जाता है जबकि नीचे का जल अधिक घनत्व के कारण नीचे ही रहता है और द्रव अवस्था में ही रहता है इसलिये जीव जन्तु तथा मछली इसमें जीवित रहते हैं।
प्रश्न 15.
द्रव अवस्था में HF अणुओं में उपस्थित दो अंतर-अणुक बलों का नाम लिखिए।
उत्तर:
HF ध्रुवीय सहसंयोजी अणु है। द्रव अवस्था में, इनमें अंतर-अणुक द्विध्रुव-द्विध्रुव आघूर्ण तथा H-आबंध उपस्थित होते हैं।
![]()
प्रश्न 16.
पूर्णतः प्रत्यास्थ टक्कर से क्या समझते हो ?
उत्तर:
गैस के अणु सभी दिशाओं में अनियमित रूप से या जिग-जैग गति करते रहते हैं तथा इस गति के दौरान ये अणु आपस में तथा पात्र की दीवार से टकराते रहते हैं। इन टक्करों के दौरान केवल इनकी दिशा में परिवर्तन होता है लेकिन इनकी गतिज ऊर्जा में कोई परिवर्तन नहीं होता है इसलिये इन टक्करों को पूर्णतः प्रत्यास्थ टक्कर कहते हैं।
प्रश्न 17.
ठण्डी गैस की तुलना में गर्म गैस का घनत्व कम क्यों होता है ?
उत्तर:
चार्ल्स के नियमानुसार किसी गैस की निश्चित द्रव्यमान का आयतन उसके परम ताप के समानुपाती होता है। अतः ताप में वृद्धि करने से आयतन में वृद्धि होती है लेकिन आयतन में वृद्धि होने से घनत्व में कमी आती है। इसलिये गर्म गैस का घनत्व ठण्डी गैस की तुलना में कम होता है।
प्रश्न 18.
ऊँचे पहाड़ों पर जाने से जी मिचलाता है तथा साँस लेने में परेशानी होती है, क्यों?
उत्तर:
ऊँचे पहाड़ों पर वायुमण्डलीय दाब में कमी आती है जिससे वायु विरल हो जाती है जिसके कारण वायुमण्डल में ऑक्सीजन की कमी हो जाती है। इसलिये जी मिचलाना व साँस लेने में परेशानी का अनुभव होता है।
प्रश्न 19.
क्रान्तिक ताप किसे कहते हैं ?
उत्तर:
क्रान्तिक ताप वह ताप है जिस पर किसी गैस को द्रवित कराया जा सकता है परन्तु इस ताप के ऊपर गैस को उच्च दाब लगाने पर भी द्रवित नहीं कराया जा सकता, इसे TC से दर्शाते हैं। उदाहरण – CO2 का क्रान्तिक ताप 31.1°C है।
प्रश्न 20.
क्रान्तिक दाब तथा क्रान्तिक आयतन किसे कहते हैं ?
उत्तर:
क्रान्तिक ताप पर किसी गैस को द्रवित कराने के लिये दाब के जिस मान की आवश्यकता होती है उसे क्रान्तिक दाब कहते हैं, इसे Pcसे दर्शाते हैं। क्रान्तिक ताप व क्रान्तिक दाब पर किसी गैस के एक अणु के आयतन को उसका क्रान्तिक आयतन कहते हैं, इसे V. से दर्शाते हैं।
प्रश्न 21.
स्वचालित वाहनों के टायर में ठण्ड की अपेक्षा गर्मी में कम वायु भरी जाती है, क्यों?
उत्तर:
जब स्वचालित वाहन गतिशील अवस्था में होता है तो टायर एवं सड़क के बीच घर्षण के कारण टायर का ताप बढ़ने लगता है जिससे टायर के अंदर भरी वायु के आयतन में वृद्धि होती है जिसके फलस्वरूप टायर पर लगने वाले दाब में भी वृद्धि होती है। गर्मी में ताप में भी वृद्धि होती है, जिससे दाब में भी अधिक वृद्धि होती है जिसके फलस्वरूप टायर के फटने की संभावना अधिक रहती है।
![]()
प्रश्न 22.
PVT In के लिए SI इकाई क्या होगी?
![]()
प्रश्न 23.
चार्ल्स के नियम के आधार पर समझाइए कि न्यूनतम संभव ताप -273°C होता है।
उत्तर:
चार्ल्स के नियमानुसार,
t = -273°C पर

अत: -273°C पर, गैस का आयतन शून्य हो जाएगा तथा इससे कम ताप पर, आयतन का मान ऋणात्मक होगा जो कि अर्थहीन है।
प्रश्न 24.
बॉयल, चार्ल्स तथा एवोगैड्रो नियम का पालन करने वाली गैस को आदर्श गैस कहते हैं। किन दशाओं में वास्तविक गैस, आदर्श गैस की भाँति व्यवहार करती है ?
उत्तर:
निम्न दाब तथा उच्च ताप पर, वास्तविक गैस आदर्श गैस की भाँति व्यवहार करती है।
प्रश्न 25.
वाष्पन और क्वथन में अंतर लिखिए।
उत्तर:
वाष्पन और क्वथन में अंतर –
वाष्पन:
- वाष्पन स्वतः होता है तथा सभी तापों पर होता है।
- वाष्पन पृष्ठीय घटना है।
- वाष्पन मंद प्रक्रम है।
क्वथन:
- क्वथन तभी होता है जब द्रव का वाष्प। दाब वायुमण्डलीय दाब के बराबर होता है।
- क्वथन संपूर्ण द्रव की घटना है।
- क्वथन तीव्र प्रक्रम है।
![]()
प्रश्न 26.
सम्पीड्यता गुणांक किसे कहते हैं ?
उत्तर:
निश्चित ताप और दाब पर किसी गैस के प्रेक्षित आयतन तथा अवलोकित आयतन (गणना से प्राप्त आयतन) का अनुपात सम्पीड्यता गुणांक कहलाता है, इसे Z से दर्शाते हैं।

आदर्श गैस के लिये Z = 1 होता है।
प्रश्न 27.
दाब बढ़ने पर बर्फ के गलनांक में क्या परिवर्तन होता है ?
उत्तर:
दाब के बढ़ने पर अणुओं की गतिज ऊर्जा में अत्यधिक वृद्धि होती है, जिसके फलस्वरूप कम तापक्रम पर ही अणुओं की गतिज ऊर्जा होने के कारण वे स्वतंत्र रूप से गति करने लगते हैं अर्थात् दाब में वृद्धि करने पर बर्फ अपने गलनांक से निम्न ताप पर ही द्रव में परिवर्तित होने लगता है।
प्रश्न 28.
समान ताप पर ईथर तथा पानी अलग-अलग हाथ पर डाले जाते हैं तो ईथर अधिक ठण्डा लगता है, क्यों?
उत्तर
ईथर में उसके अणुओं के मध्य लगने वाला अंतर-अणुक आकर्षण बल जल की तुलना में कम है इसलिये ईथर जल की तुलना में शीघ्रता से वाष्पित होता है तथा वह वाष्पन के लिये आवश्यक ऊर्जा हाथ से ग्रहण करता है इसलिये ईथर ठण्डा लगता है।
प्रश्न 29.
द्रवों में विसरण की दर मंद होती है, क्यों?
उत्तर:
द्रव में अणुओं के मध्य अंतरअणुक आकर्षण बल गैस की तुलना में अधिक होता है तथा इसके अणु एक-दूसरे के साथ इस अंतरअणुक आकर्षण बल के द्वारा गैस की तुलना में दृढ़ता से बँधे रहते हैं । इसलिये द्रव के अणु गैस के अणुओं के समान स्वतंत्र रूप से गति नहीं कर सकते इसलिये द्रव में विसरण की दर गैस की तुलना में मंद होती है।
प्रश्न 30.
गैस में प्रसार असीमित होता है, क्यों?
उत्तर:
गैस के अणुओं के मध्य अंतरअणुक आकर्षण बल नगण्य होता है, इसलिये गैस के अणु सभी दिशाओं में स्वतंत्र रूप से अनियमित रूप से गति करते रहते हैं। इनका कोई निश्चित आकार या आयतन नहीं होता है, जिसके कारण गैसों को जिस भी पात्र में रखा जाता है गैस के अणु फैलकर पात्र के बराबर आकार व आयतन ग्रहण कर लेते हैं।
![]()
द्रव्य की अवस्थाएँ लघु उत्तरीय प्रश्न
प्रश्न 1.
क्रिस्टलीय ठोस की प्रमुख विशेषताएँ लिखिये।
उत्तर:
- इनकी संरचना एक निश्चित ज्यामिति वाली होती है।
- इनकी आंतरिक संरचना में भी कणों का एक निश्चित क्रम रहता है।
- इनके गलनांक स्पष्ट तथा निश्चित होते हैं।
- ये कम ऊर्जा वाले होते हैं।
- ये विषम दैशिकता दर्शाते हैं।
- अवयवी कणों के मध्य दुर्बल वाण्डर वाल्स, आकर्षण बल या स्थिर वैद्युत आकर्षण बल होता है।
प्रश्न 2.
S.T.P. व N.T.P. से क्या समझते हो?
उत्तर:
गैस की निश्चित मात्रा का आयतन, ताप व दाब के साथ परिवर्तित होता है अर्थात् गैसों के गुण ताप तथा दाब पर निर्भर करते हैं इसलिये विभिन्न गैस के गुणों की तुलना एक निश्चित ताप एवं दाब पर की जा सकती है। इसके लिये 0°C (273 K) ताप तथा एक वायुमण्डलीय दाब (760 mm) को चुना गया है जिसे सामान्य ताप व दाब या N.T.P. कहते हैं N.T.P. पर एक मोल गैस का आयतन 224 लिटर होता है तथा 25°C (298 K) ताप तथा 1 वायुमण्डलीय दाब (760 mm) या 1 बार दाब को मानक ताप व दाब कहते हैं। S.T.P. पर एक मोल गैस का आयतन 22-4 लीटर होता है।
प्रश्न 3.
किसी गैस के संपीड्यता गुणांक Z का मान निम्न होता है –
\(Z=\frac { PV }{ nRT } \)
- आदर्श गैस के लिए Z का मान क्या होता है ?
- वास्तविक गैस के लिए बॉयल तापमान के ऊपर Z के मान पर क्या प्रभाव पड़ेगा ?
उत्तर:
- आदर्श गैस के लिए, संपीड्यता गुणांक, Z = 1.
- बॉयल तापमान से ऊपर, वास्तविक गैसें धनात्मक विचलन प्रदर्शित करती हैं। अत: Z>1.
प्रश्न 4.
आदर्श गैसों के लिए P, V तथा T में संबंध हेतु वाण्डर वाल्स समीकरण निम्न है –
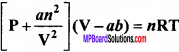
जहाँ, a तथा b वाण्डर वाल्स नियतांक है। nb गैस के अणुओं के कुल आयतन के लगभग बराबर हैं। a अंतराण्विक आकर्षण बलों के परिणाम की माप है।
- निम्नलिखित गैसों को b के बढ़ते हुए क्रम में लिखिए। कारण भी दीजिए।
O2,CO2, H2, He - निम्नलिखित गैसों के a के परिणाम के घटते हुए क्रम में लिखिए। कारण भी दीजिए।
CH4, O2, H2
उत्तर:
1. गैस के अणुओं का मोलर आयतन अणुओं का आकार तथा वाण्डर वाल्स नियतांक ‘b’ गैस के अणुओं का मोलर आयतन प्रदर्शित करता है। अतः ‘b’ का बढ़ता हुआ क्रम निम्न है –
H2 < He<O2<CO2
2. वाण्डर वाल्स नियतांक ‘a’ अंतराण्विक बलों के परिमाण की माप है। किसी अणु में इलेक्ट्रॉन मेघ का आकार बढ़ने के साथ-साथ अंतराण्विक आकर्षण बलों का परिमाण भी बढ़ता है। अतः दी गयी गैसों के लिए ‘a’ का परिणाम निम्न क्रम में घटेगा –
CH4 > O2> H2
इलेक्ट्रॉन मेघ का आकार जितना बड़ा होगा, अणु की ध्रुवण क्षमता उतनी ही अधिक होगी जिसके फलस्वरूप प्रकीर्णन बल अथवा लंदन बल उतना ही अधिक होगा।
![]()
प्रश्न 5.
बॉयल का नियम क्या है ? इसका गणितीय व्यंजक लिखिए।
उत्तर:
इस नियम के अनुसार, “स्थिर ताप पर किसी गैस की निश्चित मात्रा का आयतन (V) उसके दाब (P) के व्युत्क्रमानुपाती होता है।”
Pα – \(\frac { 1 }{ V }\)(स्थिर ताप पर)
P= स्थिरांक × \(\frac { 1 }{ V }\)
⇒ PV = स्थिरांक
अतः स्थिर ताप पर किसी गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल सदैव एक स्थिरांक होता है।
प्रारंभिक स्थिति में,
P1V1 = K. ………(1)
अंतिम स्थिति में,
P2V2 = K ………(2)
समीकरण (1) और (2) से,
P1V1 = P2V2
प्रश्न 6.
गैस स्थिरांक R की प्रकृति क्या है ?
उत्तर:
सूत्र
PV = nRT से,

अर्थात् R को ऊर्जा प्रति डिग्री प्रति मोल के द्वारा दर्शाया जाता है।
प्रश्न 7.
चार्ल्स का स्थिर दाब का नियम लिखते हुए समीकरण\(\frac { { V }_{ 1 } }{ { V }_{ 2 } } =\frac { { T }_{ 1 } }{ { T }_{ 2 } } \) व्युत्पन्न कीजिये।
उत्तर:
चार्ल्स का नियम-इस नियम के अनुसार “स्थिर दाब पर निश्चित द्रव्यमान की गैस का आयतन परम ताप के समानुपाती होता है।”
Vα T (स्थिर दाब पर)
V= स्थिरांक × T
\(\frac { V }{ T }\) = स्थिरांक
यदि प्रारम्भिक स्थिति में स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन V1 तथा ताप T1 है तो
\(\frac { { V }_{ 1 } }{ { T }_{ 1 } }\) = K ……..(1)
यदि अंतिम स्थिति में आयतन V2 तथा ताप T2 है तो
\(\frac { { V }_{ 2 } }{ { T }_{ 2 } }\) = K …….(2)
समीकरण (1) और (2) से,
\(\frac { { V }_{ 1 } }{ { V }_{ 2 } } =\frac { { T }_{ 1 } }{ { T }_{ 2 } } \)
![]()
प्रश्न 8.
चार्ल्स के नियम के आधार पर परम शून्य की धारणा को स्पष्ट कीजिये।
उत्तर:
चार्ल्स का नियम:
इस नियम के अनुसार, “स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन ताप के 1°C बढ़ने या घटने पर अपने 0°C वाले आयतन \(\frac { 1 }{ 273 }\) वाँ भाग से क्रमश: बढ़ता या घटता है।
यदि 0°C ताप पर किसी गैस का आयतन = V0घन सेमी
1°C ताप पर किसी गैस का आयतन = V0 [1+\(\frac { 1 }{ 273 }\)]
t°C ताप पर किसी गैस का आयतन = v0 [1+\(\frac { t }{ 273 }\)]
-1°C ताप पर किसी गैस का आयतन = v0 [1- \(\frac { 1 }{ 273 }\)]
-t°C ताप पर किसी गैस का आयतन = v0 [1- \(\frac { t }{ 273 }\)]
-273°C ताप पर किसी गैस का आयतन = v0 [1 – \(\frac { 273 }{ 273 }\)]
सि का आयतन = – 273°C चार्ल्स के नियम से स्पष्ट है कि ताप में कमी करने से आयतन में कमी आती है तथा -273°C ताप पर किसी भी गैस का आयतन शून्य हो जाता है। यह न्यूनतम ताप, जिस पर किसी भी गैस का आयतन शून्य हो जाता है, परम ताप कहलाता है तथा इस परम शून्य ताप पर आधारित स्केल को केल्विन स्केल कहते हैं तथा इसे T से दर्शाते हैं।
प्रश्न 9.
गे-लुसाक का नियम क्या है ?
उत्तर:
गे-लुसाक का निय:
इस नियम के अनुसार, “किसी गैस की निश्चित मात्रा का आयतन स्थिर रखने पर उसका दाब परम ताप के समानुपाती होता है।”
P α T
P= K × T
\(\frac { P }{ T }\) = K
यदि प्रारम्भिक स्थिति में दाब P1 तथा ताप T1 है तो
\(\frac { { P }_{ 1 } }{ { T }_{ 1 } }\) = K ……..(1)
T इसी प्रकार अंतिम स्थिति में दाब P2 तथा ताप T2 है तो
\(\frac { { P}_{ 2 } }{ { T }_{ 2 } }\) = K …….(2)
समी. (1) और (2) से,
\(\frac { { P }_{ 1 } }{ { T }_{ 1 } } =\frac { { P }_{ 2 } }{ { T }_{ 2 } } \)
प्रश्न 10.
एवोगैड्रो का नियम क्या है ?
उत्तर:
इस नियम के अनुसार-“स्थिर ताप और दाब पर सभी गैसों के समान आयतन में अणुओं की संख्या समान होती है।”
यदि स्थिर ताप और दाब पर किसी गैस का आयतन v है तो अणुओं की संख्या को एवोगेड्रो संख्या N से दर्शाते हैं।
V α N ………..(1)
स्थिर ताप और दाब पर गैस के मोलों की संख्या n अणुओं की संख्या N के समानुपाती होती है।
N α n
समीकरण (1) से,
V α n
⇒ \(\frac { V }{ n }\) = स्थिरांक
यदि प्रारम्भिक स्थिति में आयतन V1 तथा मोलों की संख्या n1 है तो
\(\frac { { V }_{ 1 } }{ { n }_{ 1 } }\) = स्थिरांक ………..(2)
अंतिम स्थिति में आयतन V2 तथा मोलों की संख्या n2 है तो
\(\frac { { V }_{ 2 } }{ { n }_{ 2 } }\) = स्थिरांक ………..(3)
समीकरण (2) और (3) से,
\(\frac { { V }_{ 1 } }{ { n }_{ 1 } }\) = \(\frac { { V }_{ 2 } }{ { n }_{ 2 } }\)
प्रश्न 11.
गैस समीकरण PV =nRT की स्थापना कीजिये तथा R का मान दो विभिन्न इकाइयों में लिखिए।
अथवा,
आदर्श गैस समीकरण क्या है ? इसकी स्थापना कीजिये।
उत्तर:
यदि गैस की एक निश्चित मात्रा के लिये बॉयल, एवोगैड्रो तथा चार्ल्स नियम का योग करने पर . इनके मध्य एक संबंध स्थापित हो जाता है इसे गैस समीकरण कहते हैं।
बॉयल के नियमानुसार,
V α \(\frac { 1 }{ P }\) (स्थिर ताप पर) ………..(1)
चार्ल्स के नियमानुसार,
V α T (स्थिर दाब पर) ………..(2)
एवोगैड्रो के नियमानुसार,
V α n (स्थिर ताप एवं दाब पर) ………..(3)
समीकरण (1), (2) और (3) से,
V α \(\frac { nT }{ P }\)
V = \(\frac { nRT }{ P }\)
PV = nRT
जहाँ R एक गैस स्थिरांक है।
यदि n = 1 तो PV= RT
\(\frac { PV }{ T }\) = R
यदि प्रारम्भिक स्थिति में दाब P1, आयतन V1, तथा ताप T1, है, तो
\(\frac { { P }_{ 1 }{ V }_{ 1 } }{ { T }_{ 1 } } \) = R ………..(4)
यदि अंतिम स्थिति में दोब P2, आयतन V2 तथा ताप T2, है, तो
\(\frac { { P }_{ 2 }{ V }_{ 2 } }{ { T }_{ 2 } } \) = R ………..(5)
समीकरण (4) और (5) से,
\(\frac { { P }_{ 1 }{ V }_{ 1 } }{ { T }_{ 1 } } \) = \(\frac { { P }_{ 2 }{ V }_{ 2 } }{ { T }_{ 2 } } \)
R का मान विभिन्न इकाइयों में –
- 0.0821 Litre atm K-1 mol-1
- 8.314 joule K-1 mol-1
![]()
प्रश्न 12.
एवोगैडो की परिकल्पना क्या है ? इसकी सहायता से कैसे सिद्ध करोगे कि 1 मोल गैस . का N.T.P. पर आयतन 22.4 लीटर होता है ?
उत्तर:
एवोगैड्रो का नियम:
“स्थिर ताप एवं दाब पर विभिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है।”
V α n
संबंध –
माना गैस का अणुभार M है तो इसका ग्राम अणुभार M ग्राम है।

1 लीटर गैस का N.T.P पर द्रव्यमान =\(\frac { M ×0.09 }{2.016 }\) = \(\frac { M }{22.4 }\) gm
22.4 लीटर गैस का N.T.P. पर द्रव्यमान = \(\frac { M }{22.4 }\) × 22.4
M gm = 1 मोल
अत: गैस का 1 मोल = 22.4 लीटर।
प्रश्न 13.
किसी द्रव के ताप में वृद्धि का, अणुओं के मध्य लगने वाले अंतर-आण्विक बलों पर क्या प्रभाव पड़ता है ? किसी द्रव के ताप में वृद्धि का इसकी श्यानता पर क्या प्रभाव पड़ेगा?
उत्तर:
किसी द्रव का ताप बढ़ाने पर, अणुओं की गतिज ऊर्जा में वृद्धि होती है जिसके कारण अंतराण्विक बलों का मान घट जाता है। अत: द्रव सरलता से बह सकता है जिसके कारण द्रव की श्यानता घट जाती है।
प्रश्न 14.
आदर्श गैस समीकरण की सहायता से किसी गैस का मोलर द्रव्यमान कैसे ज्ञात कर सकते हैं?
उत्तर:
आदर्श गैस समीकरण से,

प्रश्न 15.
एवोगैड्रो नियम की सहायता से अणुभार तथा वाष्य धनत्व में संबंध स्थापित कीजिए।
उत्तर:

⇒ वाष्प घनत्व = \(\frac { 1 }{2 }\) × गैस का आण्विक द्रव्यमान
अत: आण्विक द्रव्यमान = 2 × वाष्प घनत्व।
![]()
प्रश्न 16.
विभिन्न इकाइयों में R के संख्यात्मक मान लिखिये।
उत्तर:
विभिन्न इकाइयों में R के संख्यात्मक मान निम्नलिखित हैं –
- 0.0821 litre atm K-1 mol-1
- 8.31 × 10 erg K-1 mol-1
- 82.05 atm cm K-1 mol -1
- 8.31 JK-1 mol-1
- 62.3 litre mm K-1 mol-1
- 1.99 cal K-1mol-1
- 8.31 pa dm K-1 mol-1
प्रश्न 17.
गतिज समीकरण से गैस समीकरण व्युत्पन्न कीजिये।
उत्तर:
अणुगति सिद्धान्त की अभिधारणा के अनुसार, अणुओं की औसत गतिज ऊर्जा गैस के परम ताप के समानुपाती होती है।
औसत गतिज ऊर्जा = \(\frac { 1 }{2 }\)mnv2
\(\frac { 1 }{2 }\)mnv2 α T
⇒ \(\frac { 1 }{2 }\)mnv2 = KT
⇒ \(\frac { 3 }{2 }\) × \(\frac { 1 }{3}\) mnv2 = KT
⇒ \(\frac { 1 }{3}\) mnv2 = \(\frac { 2 }{3 }\) = KT
⇒ PV = \(\frac { 2 }{3 }\) KT [∵\(\frac { 1 }{3}\) mnv2 = PV]
⇒ \(\frac { PV }{T }\) = \(\frac { 2 }{3 }\) K
⇒ \(\frac { PV }{T }\) = R [ ∵\(\frac { 2 }{3 }\) K = स्थिरांक (R)]
⇒ PV = RT
प्रश्न 18.
डॉल्टन का आंशिक दाब का नियम क्या है ?
उत्तर:
आपस में क्रिया न करने वाली गैसों के मिश्रण के दाब के लिये डॉल्टन ने गैसों का आंशिक दाब का नियम प्रतिपादित किया जिसके अनुसार-“एक निश्चित ताप पर किसी निश्चित आयतन वाले पात्र में दो या दो से अधिक अक्रिय गैसों का मिश्रण लिया जाये तो मिश्रण का कुल दाब गैसों के आंशिक दाब के योग के बराबर होता है। यदि गैसों के मिश्रण का संयुक्त दाब P है तथा इसी ताप पर अवयवी गैसों का आंशिक दाब क्रमश: P1P2 तथा P3 हो, तो
P = P1 + P2+ P3.
नियम का उपयोग:
प्रयोगशाला में गैसें प्रायः जल के ऊपर एकत्रित की जाती हैं, जिनमें नमी उपस्थित रहती है। इस नियम के आधार पर शुष्क गैस का दाब = नम गैस का दाब – जल का वाष्प दाब।
प्रश्न 19.
ग्राहम के विसरण नियम को समझाकर लिखिये।
अथवा
गैसों के विसरण की दर तथा आण्विक द्रव्यमान में संबंध स्थापित कीजिए।
उत्तर:
ग्राहम का विसरण नियम-इस नियम के अनुसार, “स्थिर ताप एवं दाब पर गैसों के विसरण की दर उनके घनत्व के वर्गमूल के व्युत्क्रमानुपाती होती है।
![]()
\(r\alpha \frac { 1 }{ \sqrt { d } } \)
यदि r1 तथा r2 गैसों के विसरण की दर हैं और d1 तथा d2 उनके घनत्व हैं, तो
r1 = K \(\frac { 1 }{ \sqrt { { d }_{ 1 } } } \)
r2 = K \(\frac { 1 }{ \sqrt { { d }_{ 2 } } } \)
\(\frac { { r }_{ 1 } }{ { r }_{ 2 } } \) = \(\frac { \sqrt { { d }_{ 1 } } }{ \sqrt { { d }_{ 2 } } } \)

प्रश्न 20.
किसी आदर्श गैस द्वारा अनुभव किए गए दाब (Pआदर्श) तथा प्रेक्षित दाब (Pवास्तविक) के मध्य निम्न संबंध होता है –
Pआदर्श = Pवास्तविक + \(\frac { a{ n }^{ 2 } }{ { V }^{ 2 } } \)
(i) यदि दाब को Nm-2 में, मोलों की संख्या को mol में तथा आयतन को m3 में लिया जाए तो ‘a’ की इकाई ज्ञात कीजिए।
(ii) यदि दाब को atm में तथा आयतन को dm3 में लिया जाए तो ‘a’ की इकाई ज्ञात कीजिए।
उत्तर:
(i) a = \(\frac { P{ V }^{ 2 } }{ { n }^{ 2 } } \)
प्रश्नानुसार,
P की इकाई = Nm-2, V की इकाई = m3,n की इकाई = mol
![]()
(ii) प्रश्नानुसार, Pकी इकाई = atm, V की इकाई = dm3, n की इकाई = mol
![]()
![]()
प्रश्न 21.
ग्राहम के विसरण नियम के विभिन्न अनुप्रयोग लिखिये।
उत्तर:
- गैस का घनत्व तथा अणुभार ज्ञात करने में – यदि एक गैस के विसरण का समय तथा घनत्व ज्ञात हो तथा दूसरी गैस के विसरण का समय ज्ञात हो तो इसकी सहायता से दूसरी गैस का घनत्व तथा अणुभार ज्ञात किया जा सकता है।
- मार्श गैस सूचक – खान में काम करने वाले व्यक्ति इस सूचक की सहायता से विषैली गैसों के रिसाव से सचेत हो जाते हैं।
- गैसों के पृथक्करण में – गैसों की विसरण की दर में भिन्नता होने के कारण उन्हें उनके मिश्रण से सरलता से पृथक् किया जा सकता है।
- दुर्गन्ध – दुर्गन्ध और विषैली गैस वायु में विसरित होने के कारण पृथक् होती रहती है।
प्रश्न 22.
अणुगति सिद्धान्त के आधार पर डॉल्टन के आंशिक दाब नियम की व्युत्पत्ति कीजिये।
उत्तर:
माना किसी गैस A के n1, अणु जिनका द्रव्यमान m1, ग्राम है, एक पात्र में बंद हो जिसका आयतन v है। तो
PAV = \(\frac { 1 }{ 3 }\) m1n1V1
या PA = \(\frac { 1 }{ 3 } \frac { { m }_{ 1 }{ n }_{ 1 }{ v }_{ 1 }^{ 2 } }{ V } \)
इसी प्रकार, PB = \(\frac { 1 }{ 3 } \frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \)
यदि दोनों गैसों को उसी ताप पर उसी पात्र में बंद कर दिया जाये तो मिश्रण का दाब
P = \(\frac { 1 }{ 3 } \frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \) + \(\frac { 1 }{ 3 } \frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \)
⇒ P = PA + PB
यही डॉल्टन का आंशिक दाब का नियम है।
प्रश्न 23.
काँच के तीक्ष्ण किनारे को ज्वाला में इसके गलनांक तक गर्म करने पर यह चिकना क्यों हो जाता है ? इसके लिए उत्तरदायी द्रव के गुण का नाम लिखिए।
उत्तर:
तीक्ष्ण किनारे वाले काँच को ज्वाला में गर्म करके चिकना बनाया जाता है। क्योंकि गर्म करने पर, काँच पिघलता है तथा द्रव का किनारा गोल आकृति लेने का प्रयास करता है जिसका पृष्ठ तनाव न्यूनतम होता है। इसे काँच का ‘अग्नि-चकास’ कहते हैं।
प्रश्न 24.
‘स्तरीय प्रवाह’ पद की व्याख्या कीजिए। क्या स्तरीय प्रवाह की प्रत्येक कणों का वेग समान होता है ? अपने उत्तर की व्याख्या कीजिए।
उत्तर:
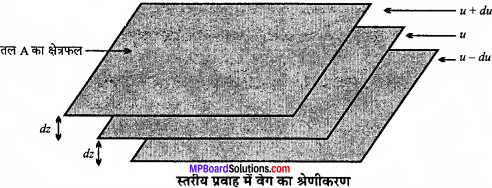
जब द्रव का प्रवाह किसी स्थिर सतह पर होता है, तब द्रव की वह परत जो सतह के संपर्क में होती है, स्थायी हो जाती है। जैसे-जैसे स्थायी परत से ऊपरी परतों की दूरी बढ़ती जाती है, वैसे-वैसे परत का वेग बढ़ता जाता है। इस प्रकार का प्रवाह, जिसमें एक परत से दूसरी परत का वेग क्रमशः बढ़ता जाता है, स्तरीय प्रवाह कहलाता है। स्तरीय प्रवाह में, सभी परतों में कणों की गति समान नहीं होती है क्योंकि परत अपने से ठीक नीचे वाली परत पर कुछ घर्षण अथवा प्रतिरोधक बल आरोपित करती है।
प्रश्न 25.
गतिज समीकरण की सहायता से एवोगैड्रो नियम की व्युत्पत्ति कीजिये।
उत्तर:
एवोगैड्रो के नियमानुसार, “समान ताप और दाब पर सभी गैसों के समान आयतन में अणुओं की संख्या समान होती है।”
हमारे पास यदि दो गैसें हैं, तो
प्रथम गैस हेतु, PV = \(\frac { 1 }{ 3 } \frac { { m }_{ 1 }{ n }_{ 1 }{ v }_{ 1 }^{ 2 } }{ V } \) ………(1)
दूसरी गैस हेतु, PV = \(\frac { 1 }{ 3 } \frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \) ………(2)
समी. (1) और (2) से,
\(\frac { 1 }{ 3 } \frac { { m }_{ 1 }{ n }_{ 1 }{ v }_{ 1 }^{ 2 } }{ V } \) = \(\frac { 1 }{ 3 } \frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \)
\(\frac { { m }_{ 1 }{ n }_{ 1 }{ v }_{ 1 }^{ 2 } }{ V } \) = \(\frac { { m }_{ 2 }{ n }_{ 2 }{ v }_{ 2 }^{ 2 } }{ V } \) ………(3)
यदि दोनों गैसों के ताप समान हैं तो उनकी गतिज ऊर्जा भी समान होगी। अर्थात्
\(\frac { 1 }{ 2 } { m }_{ 1 }{ V }_{ 1 }^{ 2 }=\frac { 1 }{ 2 } { m }_{ 2 }{ V }_{ 2 }^{ 2 }\)
\({ m }_{ 1 }{ { v }_{ 1 }^{ 2 } }={ m }_{ 2 }{ v }_{ 2 }^{ 2 }\) ………(4)
समी. (3) को समी. (4) से भाग देने पर,
![]()
n1= n2
![]()
प्रश्न 26.
गैसों के विसरण की दर की तुलना कैसे की जाती है ?
उत्तर:
माना कि दो गैसें A और B जिनके समान आयतन V के विसरण में क्रमशः t1 तथा t2 समय लगता है। तब,
r1 = \(\frac { V }{ { t }_{ 1 } } \)
r2 = \(\frac { V }{ { t }_{ 2 } } \)
\(\frac { { r }_{ 1 } }{ { r }_{ 2 } } =\frac { V }{ { t }_{ 1 } } \times \frac { { t }_{ 1 } }{ V } =\frac { { t }_{ 1 } }{ { t }_{ 2 } }\)
अतः \(\frac { { r }_{ 1 } }{ { r }_{ 2 } } =\frac { \sqrt { { d }_{ 1 } } }{ \sqrt { { d }_{ 2 } } } \)
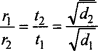
प्रश्न 27.
आदर्श गैस किसे कहते हैं ? इसकी विशेषताएँ लिखिये।
उत्तर:
आदर्श गैस या वास्तविक गैस:
वह गैस जो गैस नियमों का या गैस समीकरण का प्रत्येक दाब व ताप पर दृढ़ता से पालन करती है तो उसे आदर्श गैस कहते हैं।
विशेषताएँ:
- स्थिर ताप पर गैस के दाब व आयतन का गुणनफल सदैव स्थिर होना चाहिये तथा स्थिर ताप पर PV तथा P के मध्य खींचा गया ग्राफ एक क्षैतिज रेखा होनी चाहिये।
- यदि आदर्श गैस को स्थिर दाब पर ठण्डा किया जाये तो इसका आयतन लगातार घटना चाहिये और -273°C ताप पर शून्य होना चाहिये।
- बिना बाहरी कार्य के इसके प्रसार या संकुचन में कोई ऊष्मीय प्रभाव नहीं होना चाहिये। (4) आदर्श गैस का संपीड्यता गुणांक Z = PV का मान 1 होता है।
प्रश्न 28.
वास्तविक गैस क्या है ? इसकी विशेषताएँ लिखिये।
उत्तर:
वे गैसें जो बॉयल नियम, चार्ल्स नियम तथा आदर्श गैस समीकरण का दृढ़ता से पालन नहीं करतीं, वास्तविक गैस कहलाती हैं।
विशेषताएँ:
- गैस के अणुओं के बीच आकर्षण बल नगण्य होता है।
- गैस के कुल आयतन की तुलना में एक अणु के आयतन को नगण्य नहीं माना जा सकता है।
- -273°C पर इनका आयतन शून्य नहीं होता क्योंकि अधिकांश गैसें ठण्डा करने पर इससे पहले ही द्रव अवस्था में परिवर्तित हो जाती हैं।
- न्यून ताप व उच्च दाब पर गैसें बॉयल तथा चार्ल्स नियम का पालन नहीं करती हैं।
प्रश्न 29.
आदर्श गैस तथा वास्तविक गैस में अंतर लिखिये।
उत्तर:
आदर्श गैस तथा वास्तविक गैस में अंतर –
आदर्श गैस:
- आदर्श गैस, आदर्श गैस समीकरण का पालन करती है।
- गैस के अणुओं का आयतन पात्र की तुलना में में नगण्य होता है।
- गैस के अणुओं में परस्पर आकर्षण नहीं होता है।
- किसी आदर्श गैस का अस्तित्व नहीं है।
- आदर्श गैसों के लिये संपीड्यता गुणांक का मान 1 होता है।
वास्तविक गैस:
- वास्तविक गैस निम्न दाब और उच्च ताप पर ही आदर्श गैस समीकरण का पालन करती है।
- गैस के अणुओं का आयतन पात्र की तुलना में नगण्य नहीं होता है।
- अणुओं के मध्य आकर्षण होता है।
- सभी गैसें वास्तविक गैसें हैं तथा वे आदर्श गैसों के व्यवहार से कभी धनात्मक तथा कभी ऋणात्मक विचलन दर्शाती हैं।
- वास्तविक गैसों के लिये सम्पीड्यता गुणांक का मान 1 नहीं होता है।
प्रश्न 30.
अणुगतिक सिद्धान्त के आधार पर बॉयल के नियम को समझाइये।
उत्तर:
किसी भी गैस का दाब उसके अणुओं के पात्र की दीवारों से टकराने के कारण उत्पन्न होता है। अर्थात् दाब का परिमाण टक्करों की आवृत्ति पर निर्भर करता है तथा टक्करों की आवृत्ति अणुओं की संख्या तथा उनके वेग पर निर्भर करती है। यदि गैस का आयतन कम कर दिया जाये तो इकाई आयतन में उपस्थित अणुओं की संख्या बढ़ जायेगी, जिसके फलस्वरूप इकाई समय में दीवार की इकाई क्षेत्रफल पर टकराने वाले अणुओं की संख्या में भी वृद्धि होगी, जिसके कारण दाब में भी वृद्धि होगी।
दूसरी तरफ यदि आयतन में वृद्धि कर दी जाये तो इकाई क्षेत्रफल में उपस्थित अणुओं की संख्या में कमी आयेगी, जिससे इकाई समय में दीवार की इकाई क्षेत्रफल पर होने वाली टक्करों की संख्या में कमी आयेगी, जिससे दाब में भी कमी आयेगी। अतः स्पष्ट है स्थिर ताप पर किसी गैस की निश्चित मात्रा का आयतन उसके दाब के व्युत्क्रमानुपाती होता है।
प्रश्न 31.
गैसों के अणुगतिक समीकरण की सहायता से चार्ल्स के नियम की व्याख्या कीजिए।
उत्तर:
गैस का ताप बढ़ाने पर उसकी गतिज ऊर्जा भी बढ़ती है जिसके फलस्वरूप अणुओं के वेग में वृद्धि होती है और वेग में वृद्धि के कारण अणुओं के मध्य होने वाली टक्करों की संभावना में वृद्धि होती है। जिस बल से वे टकराते हैं उसमें वृद्धि होने लगती है जिसके फलस्वरूप दाब में वृद्धि होने लगती है।
यदि दाब को स्थिर रखना है तो यह जरूरी है कि अणुओं के मध्य होने वाली टक्करों की संभावना में वृद्धि न हो। यह तभी संभव है जब गैस के अणुओं के बीच की दूरी में वृद्धि कर दी जाये अर्थात् आयतन में वृद्धि की जाये । इससे स्पष्ट है कि स्थिर दाब पर गैस की निश्चित मात्रा का आयतन उसके परम ताप के समानुपाती है।
![]()
द्रव्य की अवस्थाएँ दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
क्रिस्टलीय ठोस व अक्रिस्टलीय ठोस में अंतर लिखिये।
उत्तर:
क्रिस्टलीय ठोस व अक्रिस्टलीय ठोस में अंतर –
क्रिस्टलीय ठोस:
- इनकी कोई निश्चित ज्यामिति नहीं होती है।
- इनकी आंतरिक संरचना में भी कणों का एक निश्चित क्रम रहता है।
- इनके गलनांक स्पष्ट तथा निश्चित होते हैं।
- ये विषम दैशिकता दर्शाते हैं।
- इन ठोसों को वास्तव में ठोस माना जाता है।
- इनमें long range order होता है।
अक्रिस्टलीय ठोस:
- इनकी एक निश्चित ज्यामिति होती है।
- इनकी आंतरिक संरचना में कणों का कोई निश्चित क्रम नहीं रहता है।
- इनके गलनांक स्पष्ट तथा निश्चित नहीं होते हैं।
- ये सम दैशिकता दर्शाते हैं।
- अक्रिस्टलीय ठोसों को अतिशीतित द्रव माना जाता
- इनमें short range order होता है।
प्रश्न 2.
गैसों के अणुगतिक सिद्धान्त के प्रमुख अभिगृहीत लिखिये।
उत्तर:
गैसों के अणुगतिक सिद्धान्त के प्रमुख अभिगृहीत निम्नलिखित हैं –
- प्रत्येक गैस सूक्ष्म कणों से मिलकर बना होता है, जिन्हें अणु कहते हैं।
- एक ही गैस के सभी अणु समान होते हैं लेकिन भिन्न-भिन्न गैसों के अणु भिन्न-भिन्न होते हैं।
- साधारण दाब पर गैस के अणु इतने छोटे होते हैं कि उनका वास्तविक आयतन गैस द्वारा घेरे गये कुल आयतन की तुलना में नगण्य होता है।
- किसी गैस के अणु हमेशा तीव्र गति से प्रत्येक दिशा में यादृच्छिक विभिन्न वेग से गतिशील रहते हैं। ये अणु हमेशा सीधी रेखा में गति करते हैं। परन्तु अन्य अणु या पात्र की दीवार से टकराकर उनकी दिशा बदल जाती है।
- अणुओं के मध्य संघट्ट पूर्णतः प्रत्यास्थ होती है। इसलिये टक्करों के पश्चात् अणुओं की ऊर्जा में कमी नहीं आती है।
- गैस के अणुओं के मध्य आकर्षण बल नगण्य होता है तथा वह पूर्णतः प्रत्यास्थ पिंड होते हैं।
- गैस का दाब गैस के अणुओं के आपस में तथा पात्र की दीवारों से टकराने पर उत्पन्न होता है।
- गैस के अणुओं की गति पर गुरुत्वाकर्षण बल का प्रभाव नगण्य होता है।
- किसी गैस की गतिज ऊर्जा उसके परम ताप के समानुपाती होती है।
प्रश्न 3.
गैसों के अणुगतिक समीकरण PV = \(\frac { 3 }{ 2 }\)mnv2 को सिद्ध कीजिए।
उत्तर:
माना एक घनाकार पात्र में कुछ गैस ली गई है, जिसमें प्रत्येक भुजा की लम्बाई = l cm, पात्र में गैस के अणुओं की संख्या = n, गैस के एक अणु की संहति = m, गैस का कुल द्रव्यमान = M, अणुओं के वर्ग माध्य मूल वेग = v. पात्र में n अणु सभी संभावित दिशाओं में गति कर रहे हैं तथा अणु घनाकार पात्र के अंदर तीन अक्षों x, y, z में गति कर रहा है। अतः यह माना जा सकता है कि – अणु किन्हीं दो समान्तर फलकों की ओर गति कर रहा है।
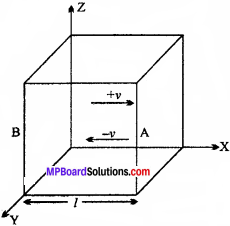
माना कोई अणु दो फलक A तथा B के बीच गति कर रहा है तथा फलक A पर बार-बार टकरा रहा है। यदि फलक A पर टकराने के पहले अणु का वेग v है तथा टक्कर पूर्णतः प्रत्यास्थ है इसलिये टक्कर के पश्चात् अणु का वेगv होगा। अणु का फलक से टकराने से पहले संवेग = mv अणु का फलक से टकराने के बाद संवेग = – mv अतः प्रत्येक टक्कर लगाने पर संवेग परिवर्तन = mv -(-mv) = 2mv फलक A पर दूसरी बार टकराने के लिये अणु को दूरी तय करनी पड़ेगी = 2l
∴ अणु का वेग है। सेमी / सेकण्ड
∴ सेमी दूरी तय करता है 1 सेकण्ड में
∴ 2l सेमी दूरी तय करेंगे \(\frac { 1 }{v }\) × 2l = \(\frac { 2l }{ v }\) सेकण्ड
फलक A पर \(\frac { 2l }{ v }\) सेकण्ड में अणु टकराता है 1 बार
फलक A पर 1 सेकण्ड में अणु टकराता है = \(\frac { 1 }{ \frac { 2l }{ v } } \) = \(\frac { v }{2l}\)
प्रति सेकण्ड संवेग में परिवर्तन = प्रत्येक टक्कर में संवेग परिवर्तन × 1 सेकण्ड में अणुओं की संख्या × फलक A पर टकराने वाले अणुओं की संख्या
= 2mv × \(\frac { V }{2l }\) × \(\frac { n }{3 }\) = \(\frac { 1 }{3 }\) \(\frac { mn{ v }^{ 2 } }{ l } \)
प्रति सेकण्ड संवेग में परिवर्तन की दर = बल
\(\frac { 1 }{3 }\) \(\frac { mn{ v }^{ 2 } }{ l } \) = F

![]()
प्रश्न 4.
वाण्डर वाल्स ने गैसों के आदर्श व्यवहार का स्पष्टीकरण करने के लिये गैस समीकरण में क्या संशोधन किया है ?
उत्तर:
अणुगतिक समीकरण के अनुसार गैसों के अणुओं के मध्य आकर्षण बल नगण्य होता है तथा गैस के अणुओं का वास्तविक आयतन कुल आयतन की तुलना में नगण्य होता है। लेकिन ये दोनों अभिधारणाएँ निम्न दाब एवं उच्च ताप पर ही संभव हैं क्योंकि उच्च दाब पर गैस का कुल आयतन बहुत कम हो जाता है।
इसलिये इस स्थिति में वास्तविक आयतन को कुल आयतन की तुलना में नगण्य नहीं माना जा सकता और अणु पास-पास आ जाते हैं इसलिये इनके मध्य आकर्षण बल कार्य करने लग जाता है, जिनकी उपेक्षा नहीं की जा सकती। इन दोनों दोषों को दूर करने के लिये वाण्डर वाल्स ने आदर्श गैस समीकरण में संशोधन कर नये समीकरण की व्युत्पत्ति की जिसे वाण्डर वाल्स समीकरण कहते हैं।
आयतन संशोधन:
उच्च दाब पर गैस के अणुओं के स्वयं का आयतन, गैस की आयतन की तुलना में नगण्य नहीं होता है। अतः गैस का वास्तविक आयतन (V-b) होगा जबकि b गैस के अणु का स्वयं आयतन है।
दाब संशोधन:
उच्च दाब अथवा निम्न ताप पर गैस का आयतन बहुत कम हो जाता है और अणु एकदूसरे के निकट होते हैं। इस अवस्था में अणुओं के मध्य पारस्परिक आकर्षण बल \(\frac { a }{ { V }^{ 2 } } \) बढ़ जाता है।
गैस का वास्तविक दाब = प्रेक्षित दाब + दाब संशोधन
= P + \(\frac { a }{ { V }^{ 2 } } \)
आदर्श गैस समीकरण में दोनों संशोधन करने पर,
[P + \(\frac { a }{ { V }^{ 2 } }\)] [V – b] = RT
n मोल गैस हेतु,
\(p+\frac { a{ n }^{ 2 } }{ { V }^{ 2 } }\) [V – nb] = nRT
प्रश्न 5.
श्यानता या विस्कासिता से आप क्या समझते हैं ? श्यानता को कौन-कौन से कारक प्रभावित करते हैं ?
उत्तर:
प्रत्येक द्रव में बहने की एक प्रवृत्ति होती है क्योंकि द्रव में अन्तरअणुक आकर्षण बल कम होता है और ये असंपीड्य होते हैं। कुछ द्रव जैसे-शहद, कैस्ट्रॉल तेल अत्यन्त धीमी गति से प्रवाहित होते हैं जबकि कुछ द्रव जैसे-जल, कैरोसीन आदि में बहने की प्रवृत्ति अधिक होती है। प्रवाह की गति में भिन्नता श्यानता के कारण होती है।
श्यानता वास्तव में द्रव के प्रवाह पर प्रतिरोध है और यह प्रतिरोध अंतरअणुक आकर्षण बल द्वारा प्रभावित होता है। द्रवों को कई पर्तों से मिलकर बना हुआ समझा जाता है। जब कोई द्रव किसी भी सतह पर बहता है ये पर्ते भिन्न-भिन्न वेग से बहती हैं । द्रव की विभिन्न पर्तों में उपस्थित अणु एक-दूसरे द्वारा आकर्षित होते हैं और ये अंतरअणुक आकर्षण बल द्रव के प्रवाह पर प्रतिरोध उत्पन्न करता है।
श्यानता को प्रभावित करने वाले कारक –
- अंतरअणुक आकर्षण बल – अंतरअणुक आकर्षण बल द्रव में अणुओं के प्रवाह को अवरुद्ध करते हैं । इसलिये अंतरअणुक आकर्षण बल पर श्यानता निर्भर करती है। जितना अधिक अंतरअणुक आकर्षण बल होगा, द्रव की श्यानता भी उतनी अधिक होगी।
- अणुभार – अणुभार बढ़ने पर श्यानता बढ़ती है।
- दाब – दाब बढ़ने पर आयतन में कमी आती है जिसके फलस्वरूप अंतर अणुक आकर्षण बल में वृद्धि होती है इसलिये दाब में वृद्धि करने से श्यानता में वृद्धि होती है।
- ताप – ताप में वृद्धि करने से द्रव के प्रवाह को अवरुद्ध करने वाला ससंजक बल कम हो जाता है जिससे आण्विक गति में वृद्धि होती है। अतः श्यानता में कमी आती है।
प्रश्न 6.
पृष्ठ तनाव क्या है ? इसे प्रभावित करने वाले कारकों का विवरण दीजिए।
उत्तर:
यह द्रव का एक महत्वपूर्ण गुण है, जिसके कारण उसका स्वतंत्र पृष्ठ एक प्रत्यास्थ झिल्ली की तरह व्यवहार करता है तथा वह कम-से-कम क्षेत्रफल घेरने की चेष्टा करता है, पृष्ठ तनाव कहलाता है। पृष्ठ तनाव अन्तराअणुक आकर्षण बल पर निर्भर करता है। द्रव के अंदर स्थित समीपवर्ती अन्य अणु द्वारा सभी दिशाओं में समान रूप से आकर्षित होते हैं किन्तु द्रव की सतह पर स्थित अणु केवल नीचे तथा बाजू में स्थित अणुओं द्वारा आकर्षित होते हैं जिसके फलस्वरूप सतह के अणु अंदर की ओर आकर्षित होते हैं तथा सतह की प्रवृत्ति क्षेत्रफल को कम करने की होती है।
संकुचित होने की प्रवृत्ति के कारण द्रव की सतह तनी हुई झिल्ली के समान कार्य करती है। इस घटना को पृष्ठ तनाव कहते हैं। पृष्ठ तनाव उस कार्य की माप है जो द्रव की सतह को एकांक क्षेत्रफल से बढ़ाने के लिये आवश्यक है। इसका S.I. मात्रक जूल / मीटर या न्यूटन / मीटर है।
पृष्ठ तनाव को प्रभावित करने वाले कारक –
(1) ताप – ताप में वृद्धि करने पर अंतर अणुक आकर्षण बल में कमी के कारण पृष्ठ तनाव में कमी आती है।
(2) विलेय – द्रवों में विलेय मिलाने पर पृष्ठ तनाव प्रभावित होता है।
- यदि विलेय का पृष्ठ तनाव द्रव के पृष्ठ तनाव के बराबर हो तो द्रव का पृष्ठ तनाव विलेय की मात्रा के समानुपाती होता है। जितना अधिक विलेय मिलाते हैं पृष्ठ तनाव में उतनी वृद्धि होती है।
- यदि विलेय का पृष्ठ तनाव द्रव के पृष्ठ तनाव से कम हो तो द्रव के पृष्ठ तनाव में कमी आती है।
- द्रवों का पृष्ठ तनाव सतह को सक्रिय करने वाले पदार्थ जैसे-साबुन, डिटर्जेन्ट मिलाने पर कम हो जाता है।
![]()
प्रश्न 7.
आयनिक, सहसंयोजी, धात्विक तथा आण्विक क्रिस्टल में तुलना कीजिये।
उत्तर:
आयनिक, सहसंयोजी, धात्विक तथा आण्विक क्रिस्टल में तुलना –
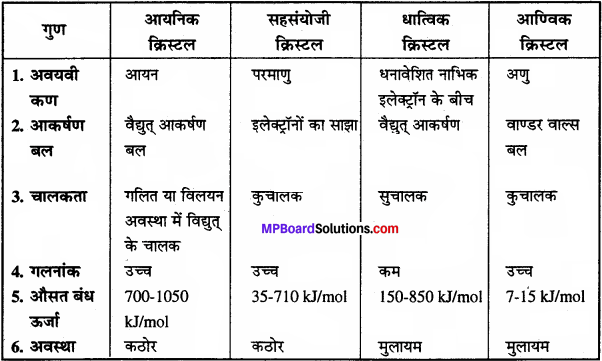
प्रश्न 8.
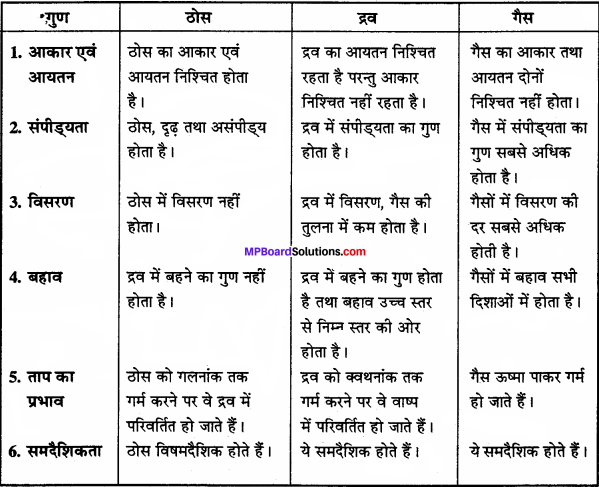
ठोस, द्रव तथा गैस में क्या संरचनात्मक भिन्नताएँ हैं ? लिखिये।
उत्तर:
ठोस, द्रव तथा गैस में संरचनात्मक भिन्नताएँ –