MP Board Class 11th Chemistry Solutions Chapter 2 परमाणु की संरचना
परमाणु की संरचना NCERT अभ्यास प्रश्न
परमाणु की संरचना के प्रश्न अभ्यास MP Board Class 11th Chemistry प्रश्न 1.
- एक ग्राम में इलेक्ट्रॉनों की संख्या की गणना कीजिए।
- एक मोल इलेक्ट्रॉन का द्रव्यमान एवं आवेश की गणना कीजिए।
हल:
1. एक इलेक्ट्रॉन का द्रव्यमान = 9.11 x 10-31 kg, इलेक्ट्रॉन का कुल द्रव्यमान = 1g = 1 x 10-3kg
∴ 9.11 x 10-31 kg द्रव्यमान एक इलेक्ट्रॉन का है।
∴ 1 x 10-3 kg द्रव्यमान एक इलेक्ट्रॉन का है = \(\frac { 1×10^{ -3 } }{ 9.11×10^{ -31 } } \) = 1.09×1027 इलेक्ट्रॉन।
2. इलेक्ट्रॉन का द्रव्यमान = 9.1×10-28 ग्राम
1 मोल इलेक्ट्रॉन = 6.023 x 103 इलेक्ट्रॉन
1 मोल इलेक्ट्रॉन का द्रव्यमान = 9.1 x 10-28 x 6.023 x 1023
= 5.47 x 10-4 ग्राम।
इलेक्ट्रॉन का आवेश = 1.6 x 10-19 कूलॉम
1 मोल इलेक्ट्रॉन = 6.023 x 1023
1 मोल इलेक्ट्रॉन का आवेश = 1.6 x 10-19 x 6.023 x 1023
= 9.63 x 104 कूलॉम।
परमाणु की संरचना अभ्यास MP Board Class 11th Chemistry प्रश्न 2.
- एक मोल मेथेन में उपस्थित कुल इलेक्ट्रॉनों की गणना कीजिए।
- 7mg C14 में कुल न्यूट्रॉनों की संख्या एवं कुल द्रव्यमान की गणना कीजिए।
- STP पर NH3 के 34 mg में कुल प्रोटॉनों की संख्या एवं प्रोटॉनों का द्रव्यमान ज्ञात कीजिए।
हल:
1. CH4 के एक मोल में इलेक्ट्रॉन = 6 + 4 = 10
CH4 के एक मोल = 6.02 x 1023 अणु
कुल इलेक्ट्रॉन = 10 x 6.02 x 1023 = 6.02 x 1024.
2. एक C14 परमाणु में न्यूट्रॉनों की संख्या = 14 – 6 = 8
एक मोल C14 अथवा 6.02 x 1023 परमाणु अथवा 14g
एक मोल C14 में न्यूट्रॉन है = 8 x 6.02 x 1023
= 4.816 x 1024
C14 के 7 mg = C14 के 7 x 10-3
∴ 14 ग्राम C14 में न्यूट्रॉन्स है = 4.816 x 1024
∴ 7 x 10 C14 में न्यटॉन्स है = \(\frac { 4.816×10^{ 24 }x7x10^{ -3 } }{ 14 } \)
= 2.408 x 1021 न्यूट्रॉन्स।
एक न्यूट्रॉन का द्रव्यमान = 1.675 x 10-27 kg
∴ कुल न्यूट्रॉनों का द्रव्यमान = 1.675 x 10-27-27 x 2.408 x 1021 = 4.03 x 10-6 kg.
3. NH3 का मोलर द्रव्यमान = 17,
NH3 के एक अणु में प्रोटॉनों की संख्या = 7 + 3 = 10
34 mg NH3 = 34 x 10-3 kg
∴ 17 g NH3 में प्रोटॉन = 10 x 6.02 x 1023
34 x 10-3 g NH3 प्रोटॉन है = \(\frac { 10×6.02×10^{ 23 }x34x10^{ -3 } }{ 17 } \)
= 1.2044 x 1022 प्रोटॉन।
एक प्रोटॉन का द्रव्यमान = 1.675 x 10-7 kg
∴ कुल प्रोटॉनों का द्रव्यमान = 1.675 x 10-27 x 1.2044 x 1022
= 2.01 x 10-5 kg.
परमाणु की संरचना के प्रश्न उत्तर MP Board Class 11th Chemistry प्रश्न 3.
निम्न तत्वों के नाभिकों में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की संख्या ज्ञात कीजिए –
- \(_{ 6 }^{ 13 }{ C }\)
- \(_{ 16 }^{ 8 }{ O }\)
- \(_{ 24 }^{ 12 }{ Mg }\)
- \(_{ 56 }^{ 26 }{ Fe }\)
- \(_{ 88 }^{ 38 }{ Sr }\).
उत्तर:
- \(_{ 6 }^{ 13 }{ C }\) में न्यूट्रॉनों की संख्या – 13 – 6 = 7; \(_{ 6 }^{ 13 }{ C }\) में प्रोटॉनों की संख्या = 6.
- \(_{ 16 }^{ 8 }{ O }\) में न्यूट्रॉनों की संख्या = 16 – 8 = 8; \(_{ 16 }^{ 8 }{ O }\) में प्रोटॉनों की संख्या = 8.
- \(_{ 24 }^{ 12 }{ Mg }\) में न्यूट्रॉनों की संख्या = 24 – 12 = 12; \(_{ 24 }^{ 12 }{ Mg }\) में प्रोटॉनों की संख्या = 12.
- \(_{ 56 }^{ 26 }{ Fe }\), में न्यूट्रॉनों की संख्या = 56 – 26 = 30; \(_{ 56 }^{ 26 }{ Fe }\) में प्रोटॉनों की संख्या = 26.
- \(_{ 88 }^{ 38 }{ Sr }\) में न्यूट्रॉनों की संख्या = 88 – 38 = 50; \(_{ 88 }^{ 38 }{ Sr }\) में प्रोटॉनों की संख्या = 38.
परमाणु की संरचना के प्रश्न उत्तर Class 11th MP Board Chemistry प्रश्न 4.
दिए गए परमाणु क्रमांक (Z) एवं परमाणु दव्यमान (A) वाले परमाणु का पूर्ण संकेत लिखिए –
- Z = 17, A = 35
- Z = 92, A = 233
- Z=4, A = 9.
उत्तर:
- \(_{ 35 }^{ 17 }{ Cl }\)
- \(_{ 233 }^{ 92 }{ U }\)
- \(_{ 9 }^{ 4 }{ C }\)Be
Mp Board 11th Chemistry Book Pdf प्रश्न 5.
सोडियम लैम्प से 580 nm तरंगदैर्घ्य (λ) वाली पीला प्रकाश उत्सर्जित होता है, पीले प्रकाश की आवृत्ति (ν) एवं तरंग संख्या (\(\overline { ν } \)) की गणना कीजिए।
हल:
λ = 580 nm = 580 x 10-9 m, c = 3 x 108 m/s
आवृत्ति, ν = \(\frac{c}{λ}\) = \(\frac { 3×10^{ 8 } }{ 580×10^{ -9 } } \)
तरंग संख्या, \(\overline { ν } \) = \(\frac{1}{λ}\) = \(\frac { 1 } { 580×10^{ -9 } } \) = 1.72 x 106m-1.
प्रश्न 6.
प्रत्येक फोटॉन की ऊर्जा ज्ञात कीजिए, जो –
- प्रकाश की आवृत्ति 3 x 105 Hz से संबंधित है
- जिसका तरंगदैर्घ्य 0.50 Å है।
हल:
1. ν = 3 x 1015 Hz, h = 6.626 x 10-34 Js
E = hν = 6.626 x 10-34 x 3 x 1015 = 1.988 x 10-18 J.
2. λ = 0.50 x 10-10m, E = hν = h\(\frac{c}{λ}\)
= \(\frac { 6.626×10^{ -34 }x3x10^{ 8 } }{ o.50×10^{ -10 } } \) = 3.98 x 10-15
प्रश्न 7.
एक प्रकाश तरंग, जिसका आवर्तकाल 2.0 x 10-10 है के लिए तरंगदैर्घ्य, आवृत्ति एवं तरंग संख्या की गणना कीजिए।
हल:

प्रश्न 8.
4000 pm वाले तरंगदैर्घ्य वाले प्रकाश के फोटॉनों की संख्या की गणना कीजिए, जो 1J ऊर्जा वाले होते हैं।
हल:
λ = 4000 pm = 4 x 10-9 m
h = 6.626 x 10-34 Js
c = 3 x 108 m/s
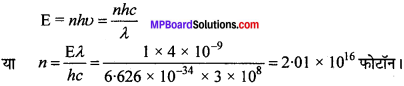
प्रश्न 9.
एक फोटॉन जिसका तरंगदैर्घ्य 4 x 10-7m है, धातु सतह पर डाला जाता है, धातु का कार्य फलन 2.13ev है। गणना कीजिए –
- फोटॉन की ऊर्जा
- उत्सर्जन की गतिज ऊर्जा एवं
- फोटो इलेक्ट्रॉन का वेग। (1eV = 1.602 x 10-19)
हल:
1. एक फोटॉन की कर्ज = E = \(\frac{hc}{λ}\)

2. उत्सर्जित इलेक्ट्रॉन की गतिज ऊर्जा, KE = hν – hν0
hν = 3.10ev (टकराने वाले फोटॉन की ऊर्जा)
hν0 = W0 = 2.13eV (धातु का कार्य फलन)
KE = 3.10 – 2.13 = 0.97eV.
3. KE = \(\frac{1}{2}\) = mv2 = 0.97e v
[∴ 1eV = 1.602 x 10-12]
\(\frac{1}{2}\) mv2 = 0.97 x 1.602 x 10-19J
\(\frac{1}{2}\) x 10-31kg x v2 = 0.97 x 1.602 x 10-19 J
[ 1e का द्रव्यमान = 9.11 x 10-31 kg]
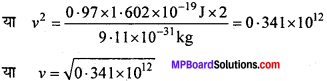
v = 5.84 x 105ms-1
प्रश्न 10.
242 nm तरंगदैर्घ्य का वैद्युत चुम्बकीय विकिरण सोडियम परमाणु को आयनीकृत करने के लिए पर्याप्त है। सोडियम की आयनन ऊर्जा की गणना kJ mol-1 में कीजिए।
हल:
तरंगदैर्घ्य λ = 242 x 10-9 m
[∴ 1 nm = 10-9 m]
ऊर्जा E = hν = \(\frac{hc}{λ}\)
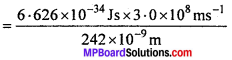
E = 0.0821 x 10-17 J/atom
उपर्युक्त ऊर्जा 1 Na परमाणु के आयनन के लिए पर्याप्त है। एक मोल Na हेतु ऊर्जा की Na की आयनन ऊर्जा होगी।
Na के 1 मोल के लिए ऊर्जा (आयनन ऊर्जा)
E = 6.02 x 1023 x 0.0821 x 10-17 J/mol
= 4.945 x 105J/mol [∴ 1 kJ = 1000J]
\(\frac { 4.945×10^{ 2 } }{ 1000 } \) J/mol
= 4.945 x 10 kJ/mol.
प्रश्न 11.
25 वाट का बल्ब 0.57 pm तरंगदैर्घ्य की मोनोक्रोमेटिक पीला उत्सर्जित करता है, तब प्रति सेकण्ड उत्सर्जित क्वाण्टम की दर की गणना कीजिए।
हल:
तरंगदैर्घ्य λ = 0.57um = 0.57 x 10-6m, [∴ l µm = 10-6m]
फाटान का ऊजा E = hν = \(\frac{hc}{λ}\)
![]()
E = 34.84 x 10-20J
25 वॉट = 25Js-1 [∴ 1वॉट = 1Js-1]

= 0.7169 x 1020 फोटॉन/सेकण्ड
= 7.169 x 1019 फोटॉन/सेकण्ड।
प्रश्न 12.
जब धातु को 6800Å तरंगदैर्घ्य वाले विकिरण में लाया जाता है, तब धातु सतह से शून्य वेग के इलेक्ट्रॉन उत्सर्जित होते हैं। धातु की देहली आवृत्ति (ν0) एवं कार्यफलन की गणना कीजिए।
हल:
देहली तरंगदैर्घ्य, λ0 = 6800Å = 6800 x 10-10 m [∴ 1A = 10-10m]
देहली आवृत्ति ν0 = C = \(\frac { c }{ \lambda _{ 0 } } \) = \(\frac { 3.0×10^{ 8 }ms^{ -1 } }{ 6800×10^{ -10 }m } \) = 4.41 x 1014s-1
कार्य फलन W = hν0
= 6.626 x 10-34 Js x 4.41 x 1014s-1
= 29.22 x 10-20 J = 2.922 x 10-19 J.
प्रश्न 13.
जब हाइड्रोजन परमाणु के इलेक्ट्रॉन ऊर्जा स्तर n = 4 से ऊर्जा स्तर n = 2 पर संक्रमण करते हैं, तब उत्सर्जित प्रकाश की तरंगदैर्ध्य क्या होगी?
हल:

इस तरंगदैर्घ्य वाले प्रकाश का रंग नीला होता है।
प्रश्न 14.
H – परमाणु को आयनीकृत करने के लिए कितनी ऊर्जा की आवश्यकता होगी, जब इलेक्ट्रॉन n = 5 कक्ष ग्रहण करेगा? H – परमाणु के आयनन एन्थैल्पी से अपने उत्तर की तुलना कीजिए। (n = 1 कक्ष से इलेक्ट्रॉन निकालने के लिए आवश्यक ऊर्जा)
हल:
ऊर्जा परिवर्तन, ∆E = Ef – Ei

अतः प्रथम कक्षक से इलेक्ट्रॉन उत्सर्जित करने के लिए आवश्यक ऊर्जा पाँचवें कक्ष से इलेक्ट्रॉन उत्सर्जित करने के लिए आवश्यक ऊर्जा की 25 गुना होगी।
प्रश्न 15.
जब हाइड्रोजन परमाणु में इलेक्ट्रॉन n = 6 से उत्तेजित होकर आद्य अवस्था में पहुँचता है, तब उत्सर्जित रेखाओं की अधिकतम संख्या क्या होगी?
हल:
संभावित संक्रमण है –
6 → 5, 6 → 4, 6 → 3, 6 → 2, 6 → 1 (5)
5 → 4, 5 → 3, 5 → 2, 5 → 1 (4)
4 → 3, 4 → 2, 4 → 1 (3)
3 → 2, 3 → 11 (2)
2 → 1 (1)
कुल रेखा = 15
रेखाओं की संख्या को सरल सूत्र द्वारा भी गणना कर सकते हैं –
\(\frac{n(n-1)}{2}\) = \(\frac{6(6-1)}{2}\) = 15.
प्रश्न 16.
1. हाइड्रोजन परमाणु के प्रथम कक्ष से संलग्न ऊर्जा -2.8 x 10-18J atom-1 है। पाँचवें कक्ष की संलग्न ऊर्जा क्या होगी?
हल:

2. हाइड्रोजन परमाणु के लिए बोर के पाँचवें कक्ष के लिए त्रिज्या की गणना कीजिए।
हल:
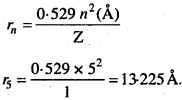
प्रश्न 17.
परमाण्विक हाइड्रोजन के बामर श्रेणी में संक्रमण के लिए सबसे लम्बी तरंगदैर्घ्य की तरंग संख्या की गणना कीजिए।
हल:
\(\overline { ν } \) = 1097 x 1o7 [ \(\left[\frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}}\right]\)
n1 = 2 बामर श्रेणी के लिए n1 = 2 लम्बी तरंगदैर्घ्य के लिए \(\overline { ν } \) कम होता है, n2 = 3.
\(\overline { ν } \) = 1097 x 107(\(\frac{1}{4}\) – \(\frac{1}{9}\) ) = 152 x 106m.
प्रश्न 18.
हाइड्रोजन परमाणु में इलेक्ट्रॉन प्रथम बोर कक्ष से पाँचवें बोर कक्ष में जाने के लिए आवश्यक जूल में ऊर्जा क्या होगी एवं इलेक्ट्रॉन के वापस आद्य अवस्था में लौटने पर उत्सर्जित प्रकाश की तरंगदैर्ध्य क्या होगी? आद्य अवस्था में इलेक्ट्रॉन ऊर्जा -2.18 x 10-1111 अर्ग है।
हल:

प्रश्न 19.
हाइड्रोजन परमाणु की इलेक्ट्रॉन ऊर्जा En = (-2.18 x 10-18)n2J दी गई है। n = 2 कक्ष इलेक्ट्रॉन को पूर्ण रूप से निकालने के लिए आवश्यक ऊर्जा की गणना कीजिए। इस संक्रमण में प्रयुक्त की लम्बी तरंगदैर्घ्य cm में क्या होगी?
हल:

प्रश्न 20.
2.05 x 10 ms-1 वेग से घूम रहे इलेक्ट्रॉन के तरंगदैर्घ्य की गणना कीजिए।
हल:
h = 6.62 x 10-34 Js,
v = 2.05 x 10 ms-1
m = 9.11 x 10-31 kg
![]()
प्रश्न 21.
एक इलेक्ट्रॉन का द्रव्यमान 9.1 x 10-31 kg है, यदि इसकी गतिज ऊर्जा (K.E.) 3 x 10-25 J हो, तब इसकी तरंगदैर्घ्य की गणना कीजिए।
हल:
K.E. = 3.0 x 10-25 J,
m = 9.1 x 10-31-31 kg,
1J = 1 kg ms-2
K.E. = \(\frac{1}{2}\) mv2

प्रश्न 22.
निम्न में से कौन-सी समइलेक्ट्रॉनिक स्पीशीज हैं अर्थात् जिनमें समान संख्या में इलेक्ट्रॉन हो –
Na+, K+, Mg+2, Ca+22+, s-2, Ar.
उत्तर:
Na+ = 11 – 1 = 10
K+ = 19 – 1 = 18
Mg+2 = 12 – 2 = 10
Ca2+ = 20 – 2 = 18
s2- = 16 + 2 = 18,
Ar= 18.
अतः समइलेक्ट्रॉनिक स्पीशीज Na+ एवं Mg+2 तथा Ca+2, K+, Ar, एवं S2- हैं।
प्रश्न 23.
(i) निम्न आयनों के इलेक्ट्रॉनिक विन्यास लिखिए –
- H+
- Na+
- O2-
- F–
(ii) उन तत्वों के परमाणु क्रमांक क्या होंगे, जिनके बाहरी कक्ष में इलेक्ट्रॉनों को दर्शाते हैं –
- 3s1
- 2p एवं
- 3p5
(iii) निम्न विन्यासों द्वारा कौन-से परमाणुओं को दर्शाया जाता है –
- [He]2s1
- [Ne]3s2, 3p3
- [Ar]4s2, 3d1.
उत्तर:
(i)
- 1H = 1s1 ∴ H = 1s0
- 11Na = 1s2 2s22p63s1 ∴ Na+ = 1s22s22p6
- 8O = 1s2 2s2 2p4 ∴ O2- = 1s2 2s2 2p6
- 9F = 1s2 2s2 2p5 ∴ F– = 1s2 2s2 2p6
(ii)
- 1s2 2s2 2p6 3s1 (Z = 11)
- 1s2 2s2 2p3 (Z = 7)
- 1s2 2s2 2p6 3s2 3p5 (Z = 17)
(iii)
- 2Li
- 1515P
- 21Sc.
प्रश्न 24.
‘g’ कक्षक रखने वाले n का निम्नतम मान क्या होगा?
उत्तर:
l = 4,
‘g’ उपकक्षक दर्शाता है एवं हमें ज्ञात है कि n = 1 एवं l = 0 से (n – 1) निम्नतम मान n = 5 है।
प्रश्न 25.
एक इलेक्ट्रॉन 3d कक्षकों में से एक में है, तब इस इलेक्ट्रॉन की n, I एवं m के संभावित मान दीजिए।
उत्तर:
3d कक्षक के लिए n = 3, l = 2, m = -2, -1, 0, +1, 2.
प्रश्न 26.
एक तत्व के परमाणु में 29 इलेक्ट्रॉन एवं 35 न्यूट्रॉन है। तब
- प्रोटॉनों की संख्या एवं
- तत्व का इलेक्ट्रॉनिक विन्यास निकालिए।
उत्तर:
- उदासीन परमाणु के लिए, प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या = 29 अत: Z = 29.
- Z = 29 का इलेक्ट्रॉनिक विन्यास = [Ar] 3d10, 4s1 है।
प्रश्न 27.
H2+ एवं O2+ स्पीशीज में इलेक्ट्रॉनों की संख्या दीजिए।
उत्तर:
H2 = 1H + 1H = 2e– ∴ H2+ = 2 – 1 = 1e– है।
O2 = O8 + O8 = 16e– ∴ O2+ = 16 – 1 = 15e– है।
प्रश्न 28.
- एक परमाणु कक्षक में n = 3 के लिए। एवं m के संभावित मान क्या होंगे?
- 3d कक्षक के इलेक्ट्रॉनों के लिए क्वाण्टम संख्याओं (m1 एवं।) की लिस्ट दीजिए।
- निम्न में से कौन-सी कक्षक संभव है – 1p, 2s, 2p एवं 3f.
उत्तर:
1. n = 3, l = 0, 1, 2
जब l = 0, m = 0
जब l = 1, m = +1, 0, -1
जब l = 2, m = +2, +1, 0, -1, -2.
2. 3d – कक्षक के लिए n = 3, l = 2, m = +2, +1, 0, -1,-2.
3. n = 1, l = 0, एक कक्षक i.e., यह संभव है। 1p संभव नहीं है।
n = 2, l = 0 एवं 1, अत: 25 एवं 2p दोनों संभव है।
n = 3, l = 0, 1, 2, अत: 3s, 3p एवं 3d संभव है 3f संभव नहीं है।
प्रश्न 29.
s, p, d नोटेशन का उपयोग करते हुए कक्षक का निम्न क्वाण्टम संख्याओं की व्याख्या कीजिए –
- n = 1, l = 0
- n = 3, l = 1
- n = 4, l = 2
- n = 4, l = 3
उत्तर:
- n = 1; l = 0 : 15
- n = 3; l = 1 : 3p
- n = 4; l = 2 : 4d
- n = 4; l = 3 : 4f.
प्रश्न 30.
निम्न की व्याख्या करते हुए कारण दीजिए, कि निम्न क्वाण्टम संख्याओं के सेट संभव नहीं है –
- n = 0, l = 0, m1 = 0, ms = +1/2
- n = 1, l = 0, m1 = 0, ms = -1/2
- n = 1, l = 1, m1 = 0, ms = +1/2
- n = 3, l = 3, m1 = 0, ms = -1/2
- n = 3, l = 3, m1 = -3, ms = +1/2
- n = 3, l = 1, m1 = 0, ms = +1/2.
उत्तर:
- संभव नहीं है, क्योंकि n शून्य नहीं होता,
- संभव है,
- संभव नहीं है, क्यों कि n = 1, का मान 1 नहीं होता,
- संभव है,
- संभव नहीं है, क्योंकि n = 3 के लिए। का मान 3 नहीं होता,
- संभव है।
प्रश्न 31.
एक परमाणु में कितने इलेक्ट्रॉन होंगे, जिनकी निम्न क्वाण्टम संख्यायें होंगी –
- n = 4, ms \(\frac{1}{2}\)
- n = 3, l = 0.
उत्तर:
- कुल इलेक्ट्रॉन- 2n2 = 2 x 42 = 32. इसके आधे इलेक्ट्रॉन 16 जिनके s = +1/2 या s = -1/2 होंगे।
- n = 3 एवं l = 0, तब यह ‘3s’ उपकक्ष है, जिसमें अधिकतम 2 इलेक्ट्रॉन होंगे।
प्रश्न 32.
दर्शाइये कि हाइड्रोजन परमाणु के लिए कक्ष में घूमने वाले इलेक्ट्रॉन के लिए बोर कक्ष डी ब्रॉग्ली तरंगदैर्घ्य के इन्टीग्रल मल्टीपल होती है।
उत्तर:
mvr = \(\frac{nh}{2π}\)
या 2πr = \(\frac{nh}{mv}\) …(i)
डी ब्रॉग्ली समीकरण के अनुसार λ = \(\frac{h}{mv}\), इस मान \(\frac{h}{mv}\) को समीकरण (i) में रखने पर,
2πr = nλ
अतः r तरंगदैर्घ्य (λ) के इन्टीग्रल मल्टीपल होती है।
प्रश्न 33.
He स्पेक्ट्रम के लिए बामर संक्रमण n = 4 से n = 2 के तरंगदैर्घ्य के समान हाइड्रोजन स्पेक्ट्रम में क्या संक्रमण होगा?
उत्तर:
H – के समान कण के लिए सामान्यतः \(\overline { ν } \) = RZ2(\(\left[\frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}}\right]\))
∴ He+ स्पेक्ट्रम में बामर संक्रमण के लिए n2 = 4 से n1 = 2

यह दर्शाता है कि n1 = 1 एवं n2 = 2 के लिए संक्रमण n = 2 से n = 1 होता है।
प्रश्न 34.
प्रक्रम के लिए आवश्यक ऊर्जा की गणना कीजिए – He(g)+ → He(g)2+ + e– आद्य अवस्था में H – परमाणु की आयनन ऊर्जा 2.18 x 10-18-18 J atom-1 है।
हल:
एक इलेक्ट्रॉन परमाणुक निकाय में, इलेक्ट्रॉन की ऊर्जा

= 4 x 2.18 x 10-18 J atom-1 = 8.72 x 10-8 J atom-1
अत: He+ → He2+ + e–, के लिए आवश्यक ऊर्जा = 8.72 x 10-18 J atom-1
प्रश्न 35.
कार्बन परमाणु का व्यास यदि 0.15 nm है, तब कार्बन परमाणुओं की संख्या की गणना कीजिए, जो 20 cm लम्बी स्केल पर सीधी रेखा में खिसकती है।
हल:
कार्बन परमाणु का व्यास = 0.15 nm = 1.5 x 10-10 m
लम्बाई के सापेक्ष कार्बन परमाणुओं की संख्या जो रखी गई है = \(\frac { 0.2 }{ 1.5×10^{ -10 } } \) = 1.33 x 109.
प्रश्न 36.
2 x 108 कार्बन परमाणुओं को व्यवस्थित करने के लिए 2.4 cm लम्बाई में व्यवस्थित करने के लिए कार्बन परमाणु की त्रिज्या की गणना कीजिए।
हल:
कुल लंबाई = 2.4 cm
कतार में व्यवस्थित कार्बन परमाणुओं की संख्या = 2 x 108
1 कार्बन परमाणु का व्यास = \(\frac { 2.4cm }{ 2×10^{ 8 } } \) = 1.2 x 10-8 cm

= 0.60 x 10-7 cm
= 0.060 x 10-9 cm = 0.060 x 10-9 m
= 0.060 nm.
प्रश्न 37.
जिंक परमाणु का व्यास 2.6 Å है।
- जिंक परमाणु की त्रिज्या pm में तथा
- 1.6 cm की लंबाई में कतार में लगातार उपस्थित परमाणुओं की संख्या की गणना कीजिए।
हल:
1. Zn परमाणु का व्यास = 2.6Å = 2.6 x 10-10 m
Zn परमाणु की त्रिज्या \(\frac { 2.6×10^{ -10 }m }{ 2 } \)
= 1.3 x 10-10 m
= 130 x 10-12m = 130 pm.
2. प्रश्नानुसार, लंबाई = 1.6 cm = 1.6 x 10-2 m
1.6 x 10-2 m लम्बी कतार में Zn परमाणुओं की संख्या
\(\frac { 1.6×10^{ -2 }m }{ 2.6×10^{ -10 }m } \) = 0.6154 x 108
= 6.154 x 107.
प्रश्न 38.
कुछ कण 2.5 x 10-16C स्टेटिक विद्युत् आवेश रखते हैं, इनमें उपस्थित इलेक्ट्रॉनों की संख्या की गणना कीजिए।
हल:
एक इलेक्ट्रॉन पर आवेश = 1.6 x 10-19 कूलॉम, कुल आवेश = 2.5 x 10-16
कुल इलेक्ट्रॉनों की संख्या = \(\frac { 2.5×10^{ -16 } }{ 1.6×10^{ -19 } } \) = 1562.5 = 1.5625 x 103.
प्रश्न 39.
मिलिकन प्रयोग में तेल बूंद पर स्टेटिक विद्युत् आवेश x-किरण की चमक से प्राप्त करते हैं। यदि तेल बूंद पर स्टेटिक विद्युत् आवेश -1-282 x 10-18 C है, तब इसमें उपस्थित इलेक्ट्रॉनों की संख्या की गणना कीजिए।
हल:
तेल की बूंद पर स्थिर विद्युत् आवेश = – 1.282 x 10-18 C
इलेक्ट्रॉन पर आवेश = -1.602 x 10-19 C
तेल की बूंद में उपस्थित इलेक्ट्रॉन = \(\frac { -1.282×10^{ -18 } }{ -1.602×10^{ -19 } } \)
प्रश्न 40.
रदरफोर्ड प्रयोग में सामान्यतः भारी परमाणु जैसे-गोल्ड, प्लेटिनम आदि की पतली पत्ती पर -कणों के आक्रमण के लिए उपयोग करते हैं। यदि पतली पत्ती हल्के परमाणुओं जैसेऐल्युमिनियम आदि का उपयोग करें, तब उपरोक्त परिणामों से प्रेक्षित में क्या अन्तर होगा?
उत्तर:
हल्के परमाणुओं में नाभिक में कम संख्या में धन आवेश होते हैं, इसके कारण ही -कणों की संख्या विपरीत विचलित नगण्य होती है एवं कम कोण से विचलित -कणों की संख्या भी नगण्य होती है।
प्रश्न 41.
प्रतीक \(_{ 79 }^{ 35 }{ Br }\)Br एवं 79Br लिख सकते हैं, जबकिं संकेत \(_{ 35 }^{ 79 }{ Br }\)Br एवं 35Br स्वीकार्य योग्य नहीं है, उत्तर समझाइये।
उत्तर:
तत्व की परमाणु संख्या निश्चित स्थायी होती है। द्रव्यमान संख्या समस्थानिक पर निर्भर होता है। अतः एक तत्व की परमाणु संख्या एवं द्रव्यमान संख्या को दर्शाते हैं। \(_{ 35 }^{ 79 }{ Br }\)Br संभावना नहीं है, क्योंकि Br का परमाणु क्रमांक 35 है 79 नहीं। 35Br संभव नहीं है, क्योंकि Br की द्रव्यमान संख्या 35 नहीं है।
प्रश्न 42.
एक तत्व की द्रव्यमान संख्या 81 है, तथा प्रोटॉन की तुलना में 31.7% अधिक न्यूट्रॉन है, तब परमाण्विक संकेत निकालिये।
हल:
द्रव्यमान संख्या = 81, i.e., p + n = 81
यदि प्रोटॉन की संख्या = x है, तब
न्यूट्रॉनों की संख्या = x + \(\frac{31.7x}{100}\) = 1.317x
∴ x + 1.317x = 81
या 2.317 x = 81
या x = \(\frac{81}{2.317}\) = 35
अतः प्रोटॉन = 35, i.e., परमाणु संख्या = 35
∴ संकेत Br है।
प्रश्न 43.
एक आयन की द्रव्यमान संख्या 37 है, जिस पर एक इकाई ऋण आवेश है। यदि आयन में इलेक्ट्रॉन की तुलना में 11.1% अधिक न्यूट्रॉन है, तो आयन का संकेत ज्ञात कीजिए।
हल:
यदि आयन में इलेक्ट्रॉनों की संख्या = x, तब
न्यूट्रॉनों की संख्या = x + \(\frac{11.1x}{100}\) = 1.111 x
∴ प्रोटॉनों की संख्या = x – 1
द्रव्यमान संख्या = n + p
या 37 = 1.111 x + x – 1
या 2.11 x = 38
x = 8
प्रोटॉनों की संख्या = परमाणु संख्या
= x – 1 = 18 – 1 = 17
∴ आयन का संकेत \(_{17}^{37} \mathrm{Cl}^{-1}\).
प्रश्न 44.
एक आयन की द्रव्यमान 56 है, जिस पर 3 इकाई धन आवेश है एवं इलेक्ट्रॉन की तुलना में 30.4% अधिक न्यूट्रॉन है। आयन का संकेत ज्ञात कीजिए।
हल:
यदि आयन में इलेक्ट्रॉनों की संख्या M3+ = x
न्यूट्रॉनों की संख्या = x + \(\frac{30.4}{100}\)x = 1.304 x
∴ प्रोटॉनों की संख्या = x + 3
द्रव्यमान संख्या = n + p
या 56 = x + 3 + 1.304 x
या 2.304 x = 53
x = 23
∴ प्रोटॉनों की संख्या = परमाणु संख्या
= x + 3 = 23 + 3 = 26
∴ आयन का संकेत \(_{56}^{26} \mathrm{Cl}^{+3}\) है।
प्रश्न 45.
निम्न प्रकार के विकिरणों को उसके आवृत्ति के बढ़ते क्रम में व्यवस्थित कीजिए –
- माइक्रोवेव ओवन के विकिरण
- ट्रैफिक सिग्नल का अम्बर प्रकाश
- FM रेडियो के विकिरण
- बाह्य आकाश से कास्मिक किरणें
- x-किरणें।
उत्तर:
FM रेडियो के विकिरण < माइक्रोवेव < अम्बर प्रकाश < x – किरणे < कास्मिक किरणें।
प्रश्न 46.
नाइट्रोजन लेजर 337.1 nm तरंगदैर्घ्य के विकिरण उत्पादित करता है। यदि उत्सर्जित फोटॉनों की संख्या 5.6 x 1024 है, इस लेजर की शक्ति की गणना कीजिए।
हल:
h = 6.626 x 10-34 J
λ = 337.1 x 10-9 m
c = 3 x 108 m/s
n = 5.6 x 1024
E = nhν
E = nh\(\frac{c}{λ}\)
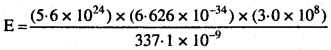
= 3.3 x 106 J.
प्रश्न 47.
निऑन गैस का सामान्यतः उपयोग साइनबोर्ड में किया जाता है। यह प्रभावी रूप से 616 nm पर उत्सर्जित करता है। गणना कीजिए –
(a) उत्सर्जन की आवृत्ति
(b) 30s में विकिरण द्वारा चली गई दूरी
(c) क्वाण्टम की ऊर्जा
(d) 2Jऊर्जा उत्पादित करने के लिए उपस्थित क्वाण्टम की संख्या।
हल:
λ = 616 nm = 616 x 10-9 m
h = 6.626 x 10-34 Js,
c = 3 x 10 m/s

प्रश्न 48.
खगोल प्रेक्षणों में दूर स्थित ग्रहों से प्रेक्षित सिग्नल सामान्यतः कमजोर होते हैं। यदि फोटॉन डिटेक्टर कुल 3.15 x 10-18J 600 nm वाले विकिरणों से प्राप्त करता है। डिटेक्टर द्वारा प्राप्त फोटॉनों की संख्या की गणना कीजिए।
हल:
c = 3 x 108 m/s
h = 6.626 x 10-34 JS,
λ = 600 x 10-9 m
एक फोटॉन की ऊर्जा = hν = h\(\frac{c}{λ}\)
= \(\frac{6 \cdot 626 \times 10^{-34} \times 3 \times 10^{8}}{600 \times 10^{-9}}\)
= 3.313 x 10-19 J
कुल प्राप्त ऊर्जा = n x एक क्वाण्टा की ऊर्जा
n (फोटॉनों की संख्या) = \(\frac { 3.15×10^{ -18 } }{ 3.31×10^{ -19 } } \) = 9.5 = 10 फोटॉनों की संख्या जो प्रभाजों में नहीं।
प्रश्न 49.
अणुओं को जीवनपर्यन्त उत्तेजित अवस्था में रहने पर नैनो सेकण्ड के नजदीक में पल्स विकिरण स्त्रोत द्वारा मापा गया। यदि विकिरण स्रोत का समय 2 ns है, एवं पल्स स्त्रोत 2.5 x 1015 में फोटॉनों की संख्या उत्सर्जित होती है। स्त्रोत की ऊर्जा की गणना कीजिए।
हल:
ν = \(\frac { 1 }{ 2×10^{ -9 } } \)
E = nhν
= 2.5 x 1015 x 6.626 x 10-34 x 0.5 x 109
= 8.28 x 10-10 J.
प्रश्न 50.
लम्बी तरंगदैर्घ्य द्विक अवशोषण संक्रमण 589 एवं 589.6 nm पर प्रेक्षित किया गया। तब प्रत्येक संक्रमण की आवृत्ति एवं दो उत्तेजित स्थितियों के बीच ऊर्जा के अन्तर की गणना कीजिए।
हल:
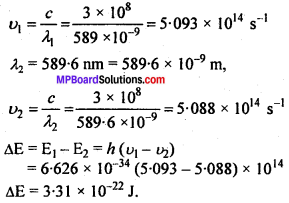
प्रश्न 51.
सीजियम परमाणु का कार्यफलन 1.9 ev है। तब विकिरण की (a) देहली तरंगदैर्घ्य एवं (b) विकिरण की देहली आवृत्ति की गणना कीजिए। यदि सीजियम तत्व तरंगदैर्घ्य 500 m द्वारा पुनः विकिरित किया जाता है। तब निकले फोटो इलेक्ट्रॉन की गतिज ऊर्जा एवं वेग की गणना कीजिए।
हल:
W0 (तरंग फलन) = hν0
देहली आवृत्ति ν0 = \(\frac { c }{ W _{ 0 } } \)
W0 = 1.9 x 1.602 x 10W-19 J,
h = 6.626 x 10W-34 Js

प्रश्न 52.
जब सोडियम धातु विभिन्न तरंगदैर्ध्य में विकिरित (Irradiated) किया जाता है, तो निम्न परिणाम प्रेक्षित किए गए –
h(nm) = 500, 400, 450, v x 105 (cm s-1) = 2.55, 4.35, 5.35. तो
- देहली तरंगदैर्घ्य एवं
- प्लांक स्थिरांक की गणना कीजिए।
हल:
हम जानते हैं किअवशोषित ऊर्जा – देहली ऊर्जा = फोटो इलेक्ट्रॉनों की गतिज ऊर्जा –

प्रश्न 53.
सिल्वर धातु को प्रकाश-विद्युत् प्रभाव प्रयोग में रखने पर सिल्वर धातु पर 0.35 V (वोल्टेज) लागू करने पर निष्कासित फोटो इलेक्ट्रॉन रूक जाते हैं, जब विकिरण 256.7 nm का विकिरण प्रयोग किया गया। सिल्वर धातु के कार्यफलन की गणना कीजिए।
हल:
λ = 256.7 nm = 256.7 x 10-9 m,
K.E. = 0.35 eV
h = 6.626 x 10-34 Js,
c = 3 x 108 m/s
E = h\(\frac{c}{λ}\)
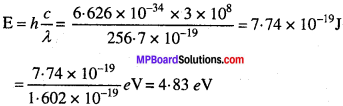
E = E0 + K.E.
4.83 = E0 + 0.35
E0 = 4.83 – 0.35 = 4.48 eV.
प्रश्न 54.
यदि 150 pm तरंगदैर्घ्य वाले फोटॉन को परमाणु पर डाला जाता है, एवं भीतर जुड़े हुए में से एक इलेक्ट्रॉन 1.5 x 107 ms-1 के वेग से बाहर निकलता है। यदि यह नाभिक से जुड़ा हुआ है, तब ऊर्जा की गणना कीजिए।
हल:
λ = 150 pm = 150 x 10-12 m = 1.5 x 10-10 m,
ν = 1.5 x 10 ms-1
m = 9.1 x 10-31 kg

प्रश्न 55.
पाश्चन श्रेणी में उत्सर्जन संक्रमण कक्ष n = 3 पर समाप्त होता है एवं कक्षn पर शुरू होते हैं, जिसे ν = 3.29 x 10-15 (Hz) \(\left[\frac{1}{3^{2}}-\frac{1}{n^{2}}\right]\) द्वारा दर्शाते हैं।
n के मान की गणना कीजिए यदि संक्रमण 1285 nm पर होता है। स्पेक्ट्रम का क्षेत्र बताइए।
हल:

प्रश्न 56.
उस उत्सर्जन संक्रमण की तरंगदैर्घ्य की गणना कीजिए, जो 1-3225 nm त्रिज्या वाले कक्ष से प्रारम्भ होकर 211.6 pm पर अन्त होती है। उस श्रेणी का नाम, जिसमें संक्रमण होता है एवं स्पेक्ट्रम का क्षेत्र बताइए।
हल:
H – जैसे आयनों के लिए,
r = \(\frac { 52.9^{ 2 } }{ Z } \)pm
r1 = 1.3225 nm = 1322.5 pm = 52.9 n12 = 25 or n = 5
r2 = 211.6 pm = 52.9 x 4 n22 = 4 or n1 = 2
अतः संक्रमण 5वें कक्ष से 2वें कक्ष में होता है। यह बामर श्रेणी में आता है।

यह दृश्य क्षेत्र में रहता है।
प्रश्न 57.
डी-ब्रॉग्ली ने पदार्थ की द्वैत प्रकृति को प्रस्तावित किया इसके बाद इलेक्ट्रॉन सूक्ष्मदर्शी की खोज के बाद उपयोग जैसे अणुओं एवं अन्य इस प्रकार के पदार्थों की उच्च मैग्नीफाइड इमेज के लिए किया गया। यदि इस सूक्ष्मदर्शी में इलेक्ट्रॉन का वेग 1.6 x 106 ms-1 हो, तब इस इलेक्ट्रॉन से संलग्न डी ब्रॉग्ली तरंगदैर्घ्य की गणना कीजिए।
हल:
λ = \(\frac{h}{mv}\),
h = 6.626 x 10-34 Js,
m = 9.1 x 10-31 kg
v = 1.6 x 106 ms-1
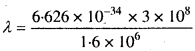
= 4.45 x 10-10m = 455 pm
प्रश्न 58.
इलेक्ट्रॉन विवर्तन के समान, न्यूट्रॉन विवर्तन सूक्ष्मदर्शी का उपयोग अणुओं की संरचना ज्ञात करने में करते हैं। यदि प्रयुक्त तरंगदैर्घ्य 800 pm की है, तब न्यूट्रॉन से संलग्न वेग की गणना कीजिए।
हल:
λ = 800 pm = 800 x 10-12 m = 8 x 10-10 m,
m = 1.675 x 10-27 kg
![]()
= 4.94 x 102 ms-1.
प्रश्न 59.
बोर के प्रथम कक्ष के इलेक्ट्रॉन का वेग 2.19 x 106 ms-1 है। इससे संलग्न डी ब्रॉग्ली तरंगदैर्घ्य की गणना कीजिए।
हल:
v = 2.19 x 106 ms-1
![]()
= 3.3243 x 10-10
m = 332.43 pm.
प्रश्न 60.
विभवान्तर 1000 V वाले घूमते प्रोटॉन से संलग्न वेग 4.37 x 105 ms-1 है, यदि 0.1 kg द्रव्यमान वाली हॉकी बॉल इस वेग से घूमती है, तो इस वेग से संलग्न तरंगदैर्ध्य की गणना कीजिए।
हल:
v = 437 x 109 ms-1,
m = 0.1 kg 2
![]()
प्रश्न 61.
यदि इलेक्ट्रॉन की स्थिति का मापन + 0.002 am की शुद्धता के साथ किया गया, इलेक्ट्रॉन की संवेग में अनिश्चितता का मापन कीजिए। माना इलेक्ट्रॉन का संवेग h/4πm x 0.05 nm है, तब इस मान की व्याख्या करने में क्या समस्या होगी?
हल:
∆x = 0.002 nm = 2 x 10-12 m,
h = 6.626 x 10-34 Js (kg m2s-1)
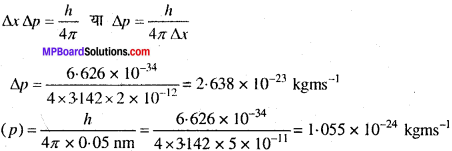
चूँकि वास्तविक संवेग मापन किए गए संवेग में अनिश्चितता से कम है, इसलिए इलेक्ट्रॉन के संवेग की व्याख्या नहीं की जा सकती है।
प्रश्न 62.
छ: इलेक्ट्रॉनों की क्वाण्टम संख्या नीचे दी गई है। इन्हें ऊर्जा के बढ़ते क्रम में व्यवस्थित कीजिए। इनमें से किसी भी संयोग में समान ऊर्जा हो, तो बताइये –
- n = 4, l = 2, m1 = – 2, ms = -1/2
- n = 3, l = 2, m1 = 1, ms = +1/2
- n = 4, l = 1, m1 = 0, ms= +1/2
- n = 3, l = 2, m1 = -2, ms = -1/2
- n = 3, l = 1, m1 = -1, ms = +1/2
- n = 4, l = 1, m1 = 0, ms = +1/2.
हल:
बहु-इलेक्ट्रॉन परमाणु की ऊर्जा (n + 1) के योग पर निर्भर करती है।
- सेट हेतु उपकोश 4d = (n + 1) = 4 + 2 = 6
- सेट हेतु उपकोश 3d = (n + 1) = 3 + 2 = 5
- सेट हेतु उपकोश 4p = (n + 1) = 4 + 1 = 5
- सेट हेतु उपकोश 3d = (n + 1) = 3 + 2 = 5
- सेट हेतु उपकोश 3p = (n + 1) = 3 + 1 = 4
- सेट हेतु उपकोश 4p = (n + 1) = 4 + 1 = 5
अतः (5) < (2) = (4) < (3) = (6) < (1)
3p < 3d = 3d < 4p = 4p < 4d (कक्षकों की ऊर्जा का बढ़ता क्रम)
प्रश्न 63.
ब्रोमीन परमाणु में 35 इलेक्ट्रॉन होते हैं, यह 6 इलेक्ट्रॉन 2p कक्ष, 6 इलेक्ट्रॉन 3p कक्ष एवं 5 इलेक्ट्रॉन 4p कक्षक में रहते हैं, इन इलेक्ट्रॉन में से किसका प्रभावी नाभिकीय आवेश कम होगा?
उत्तर:
अनुभव के आधार पर 4p इलेक्ट्रॉन का प्रभावी नाभिकीय आवेश कम हो गया क्योंकि परिरक्षण प्रभाव की तीव्रता अधिकतम होती है, यह नाभिक से दूर होता है।
प्रश्न 64.
निम्न कक्षकों के जोड़ो में से किसका अधिकतम प्रभावी नाभिकीय आवेश होगा –
- 25 एवं 3s
- 4d एवं 4f
- 3d एवं 3p.
उत्तर:
प्रभावी नाभिकीय आवेश विभिन्न कक्षक भेदन प्रभाव पर निर्भर करता है। भेदन अधिक होने पर प्रभावी नाभिकीय आवेश की तीव्रता अधिक होती है। अत:
- 2s
- 4d
- 3p
कक्षक अधिक प्रभावी नाभिकीय आवेश रखते हैं।
प्रश्न 65.
AI एवं Si में अयुग्मित इलेक्ट्रॉन 3p-कक्षक में उपस्थित होते हैं। इनमें से कौन-से इलेक्ट्रॉन नाभिक से अधिक प्रभावी नाभिकीय आवेश रखते हैं?
हल:
13Al = 1s2, 2s2 2p6, 3s2 3p1
14Si = 1s2, 2s2 2p6, 3s2 3p2
दोनों में कक्षकों की संख्या समान है। Si (+ 4) पर Al (+3) की अपेक्षा अधिक नाभिकीय आवेश होने के कारण Si में नाभिकीय आवेश अधिक प्रभावी होता है।
प्रश्न 66.
अयुग्मित इलेक्ट्रॉनों की संख्या को दर्शाइए –
- P
- Si
- Cr
- Fe
- Kr
उत्तर:
- P1515 = 1s2, 2s2, 2p6, 3s2 3px1 3py1 3pz1 (3p में 3 अयुग्मित इलेक्ट्रॉन)
- Si14 = 1s2, 2s2, 2p6, 3s2 3px1 3py1 (3p में 2 अयुग्मित इलेक्ट्रॉन)
- Cr24 = 1s2, 2s2, 2p6, 3s2 3p6 3d5, 4s1 (3d एवं 35 में 6 अयुग्मित इलेक्ट्रॉन )
- Fe26 = 1s2, 2s2 2p6, 3s2 3p6 3d6, 4s2 (3d में 4 अयुग्मित इलेक्ट्रॉन)
- Kr36 = 1s2, 2s2 2p2, 3s2 3p6 3d10, 4s2 4p6 (अयुग्मित इलेक्ट्रॉन 0)
प्रश्न 67.
- n = 4 से कितनी उपकक्ष संलग्न होती है?
- उपकक्ष, जिसके m, का मान n = 4 के लिए -1/2 होता है, में कितने इलेक्ट्रॉन उपस्थित होंगे?
हल:
1. n = 4 के लिए lmax = (n – 1)
= (4 – 1) = 3
l = 0, 1, 2, 3
उपकोश 4s, 4p, 4d, 4f चार उपकोश।
2. n = 4 के लिए कक्षकों की संख्या = n2 = 42 = 16
किसी कक्षक में अधिकतम इलेक्ट्रॉनों की संख्या = 2
प्रत्येक कक्षक में ms = \(\frac{1}{2}\) चक्रण वाले इलेक्ट्रॉनों की संख्या = 1
अत: 16 कक्षकों में ms = \(\frac{1}{2}\) चक्रण वाले इलेक्ट्रॉनों की संख्या = 16
परमाणु की संरचना अन्य महत्वपूर्ण प्रश्न
परमाणु की संरचना वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सही विकल्प चुनकर लिखिए –
प्रश्न 1.
किसी तत्व का परमाणु क्रमांक 27 और उसके परमाणु में न्यूट्रॉनों की संख्या 14 है, तो इलेक्ट्रॉनों की संख्या होगी –
(a) 14
(b) 27
(c) 13
(d) 41
उत्तर:
(c) 13
प्रश्न 2.
हुण्ड के नियम के अनुसार इलेक्ट्रॉनिक विन्यास (1s2, 2s2, 2px1, 2py1, 2pz1) किस तत्व की होगी –
(a) ऑक्सीजन की
(b) नाइट्रोजन की
(c) फ्लुओरीन की
(d) बोरॉन की।
उत्तर:
(b) नाइट्रोजन की
प्रश्न 3.
नाइट्रोजन के सातवें इलेक्ट्रॉन की चारों क्वाण्टम संख्याएँ हैं –
(a) n = 2, l = 1, m = 1, s = –\(\frac{1}{2}\)
(b) n = 2, l = 2, m = -1, s = +\(\frac{1}{2}\)
(c) n = 2, l = 1, m = +1, s = +\(\frac{1}{2}\)
(d) n = 2, l = 2, m = 2, s = +\(\frac{1}{2}\)
उत्तर:
(d) n = 2, l = 2, m = 2, s = +\(\frac{1}{2}\)
प्रश्न 4.
दिगंशी क्वाण्टम संख्या l वाले उपकोश में कुल कक्षकों की संख्या होगी –
(a) 2l + 1
(b) 3l + 1
(c) 4l + 1
(d) 2l + 1
उत्तर:
(a) 2l + 1
प्रश्न 5.
समस्थानिक में इनकी संख्या समान होती है –
(a) प्रोटॉन
(b) न्यूट्रॉन
(c) प्रोटॉन तथा न्यूट्रॉन
(d) न्यूक्लिऑन
उत्तर:
(a) प्रोटॉन
प्रश्न 6.
रदरफोर्ड के प्रयोग में किस धातु पर a-कणों की बौछार की गयी –
(a) ऐल्युमिनियम
(b) सिल्वर
(c) लोहा
(d) सोना
उत्तर:
(d) सोना
प्रश्न 7.
CO2 के एक अणु में इलेक्ट्रॉनों की संख्या निम्न में से क्या होगी –
(a) 22
(b) 44
(c) 11
(d) 38.
उत्तर:
(a) 22
प्रश्न 8.
किसी तत्व के उदासीन परमाणु में दो K, आठ L, नौ M तथा दो N इलेक्ट्रॉन हैं, तो इनमें कुल d – इलेक्ट्रॉन की संख्या होगी –
(a) 2
(b) 3
(c) 1
(d) 4.
उत्तर:
(c) 1
प्रश्न 9.
हाइजेनबर्ग के अनिश्चितता सिद्धांत के अनुसार –
(a) ∆x.∆p ≥ \(\frac{h}{4π}\)
(b) ∆x.∆ν ≥ \(\frac{h}{4π}\)
(c) ∆x \(\frac{c}{λ}\) ≥ \(\frac{h}{4π}\)
(d) ∆x.∆m ≥ \(\frac{h}{4p}\)
उत्तर:
(a) ∆x.∆p ≥ \(\frac{h}{4π}\)
प्रश्न 10.
एक परमाणु के लिए n = 3, l = 2 हो तो m के मान होंगे –
(a) – 2, – 1, 0, + 1, +2
(b) -1, 0, +1
(c) -3, -1, 0, + 1, +3
(d) -2, 0 + 1.
उत्तर:
(a) – 2, – 1, 0, + 1, +2
प्रश्न 11.
Cl– आयन में इलेक्ट्रॉनों की संख्या होगी –
(a) 17
(b) 18
(c) 35
(d) 37
उत्तर:
(b) 18
प्रश्न 12.
निम्न में से कौन-सा विन्यास ऑफबाऊ सिद्धांत के अनुकूल नहीं है –
(a) 1s2, 2s2 p1
(b) [Kr]4d10, 5s2
(c) [Ar]3a10, 4s1
(d) [Ar]3d4, 4s2
उत्तर:
(c) [Ar]3a10, 4s1
प्रश्न 13.
f उपकोश में कक्षकों की संख्या होगी –
(a) 3
(b) 4
(c) 5
(d) 7
उत्तर:
(d) 7
प्रश्न 14.
रदरफोर्ड के प्रयोग में किस धातु पर a. -कणों की बौछार की गयी –
(a) Al
(b) Ag
(c) Fe
(d) Au
उत्तर:
(d) Au
प्रश्न 15.
n = 3 के लिए। के मान होंगे –
(a) 1, 2, 3
(b) 0, 1, 2
(c) 0, 1,3
(d) उपर्युक्त में से कोई नहीं।
उत्तर:
(b) 0, 1, 2
प्रश्न 16.
बोर का परमाणु मॉडल व्याख्या कर सकता है –
(a) केवल हाइड्रोजन परमाणु का स्पेक्ट्रम
(b) एक परमाणु या आयन का स्पेक्ट्रम जिसमें केवल एक इलेक्ट्रॉन हो
(c) हाइड्रोजन अणु का स्पेक्ट्रम
(d) सूर्य का स्पेक्ट्रम
उत्तर:
(b) एक परमाणु या आयन का स्पेक्ट्रम जिसमें केवल एक इलेक्ट्रॉन हो
प्रश्न 17.
न्यूट्रॉन के भार की कोटि (Order) है –
(a) 10-23 kg
(b) 10-24 kg
(c) 10-26 kg
(d)10-27 kg
उत्तर:
(d)10-27 kg
प्रश्न 18.
K – शैल (कक्ष) के दो इलेक्ट्रॉनों में भिन्नता होगी –
(a) मुख्य क्वाण्टम संख्या में
(b) दिगंशी क्वाटम संख्या में
(c) चुम्बकीय क्वाण्टम संख्या में
(d) स्पिन (घूर्णन)क्वाण्टम संख्या में
उत्तर:
(d) स्पिन (घूर्णन)क्वाण्टम संख्या में।
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिए –
- क्लोरीन गैस का परमाणु क्रमांक 17 है। इसके बाह्यतम कक्ष में …………. इलेक्ट्रॉन होंगे।
- यदि सम्पूर्ण चुम्बकीय क्वाण्टम संख्याओं का योग 7 हो, तो दिगंशी क्वाण्टम संख्या का मान …… होगा।
- परमाणु के नाभिक में …………. और …………. होते हैं।
- न्यूट्रॉन की खोज ……….. ने की थी।
- उच्चतम तरंगदैर्घ्य वाला विकिरण …………. है।
- दिगंशी क्वाण्टम संख्या का मान एक होने पर कक्षक का आकार …………. होगा।
- नाभिक के चारों ओर का वह स्थान जहाँ इलेक्ट्रॉनों के पाये जाने की प्रायिकता अधिकतम होती है, को . …………. कहते हैं।
- एक तत्व का परमाणु क्रमांक 30 है और उसकी द्रव्यमान संख्या 66 है। इसके परमाणु में प्रोटॉन …………. न्यूट्रॉन ………… होंगे।
- चुम्बकीय क्वाण्टम संख्या …………. से संबंधित है।
उत्तर:
- 7
- 3
- प्रोटॉन, न्यूट्रॉन
- चैडविक
- रेडियो तरंग
- डम्बल
- कक्षक
- 30, 36,
- अभिविन्यास।
प्रश्न 3.
उचित संबंध जोड़िए –

उत्तर:
- (c)
- (e)
- (a)
- (d)
- (b)
- (h)
- (f)
- (g)
प्रश्न 4.
एक शब्द/वाक्य में उत्तर दीजिए –
- इलेक्ट्रॉन की खोज किसने की थी?
- डी-ब्रॉग्ली समीकरण क्या है?
- दिगंशी क्वाण्टम संख्या को किससे दर्शाते हैं?
- हाइजेनबर्ग के अनिश्चितता के सिद्धान्त का क्या सूत्र है?
- न्यूट्रॉन की खोज किसने की?
उत्तर:
- जे.जे.थॉमसन,
- λ = \(\frac{h}{mv}\)
- l
- (∆x) x (∆p) ≥ \(\frac{h}{4π}\)
- चैडविक।
परमाणु की संरचना अति लघु उत्तरीय प्रश्न
प्रश्न 1.
देहली आवृत्ति क्या है?
उत्तर:
प्रत्येक धातु के लिए, विशिष्ट न्यूनतम आवृत्ति न होती है। जिसे देहली आवृत्ति कहते हैं। इस आवृत्ति से कम मान पर प्रकाश विद्युत् प्रभाव प्रेक्षित नहीं है।
प्रश्न 2.
कार्यफलन किसे कहते हैं?
उत्तर:
किसी इलेक्ट्रॉन को उत्सर्जित करने के लिए आवश्यक न्यूनतम आवृत्ति hvo होती है। इसे कार्य फलन (wo) भी कहते हैं।
प्रश्न 3.
निम्नलिखित विकिरणों के प्रकारों को आवृत्ति के बढ़ते हुए क्रम में व्यवस्थित कीजिए –
(a) माइक्रोवेव ओवन (Oven) से विकिरण
(b) यातायात संकेत से त्रणमणि (Amber) प्रकाश
(c) एफ. एम. रेडियो से प्राप्त विकिरण
(d) बाहरी दिक् से कॉस्मिक किरणें
(e) x-किरणें।
हल:
विकिरणों की आवृत्ति का बढ़ता क्रम निम्न है –
c < a< b < e < d
प्रश्न 4.
कैथोड किरणों की दो विशेषताएँ लिखिए।
उत्तर:
विशेषताएँ:
- कैथोड किरणें सरल रेखा में गमन करती हैं। यदि इनके मार्ग में कोई अपारदर्शी ठोस पदार्थ रख दिया जाये तो ग्लास ट्यूब के दूसरी ओर उसकी छाया पड़ती है।
- ये किरणें धातुओं से टकराकर एक्स किरणें उत्पन्न करती हैं।
प्रश्न 5.
न्यूट्रॉन की खोज किस प्रकार हुई ? इसके दो लक्षण लिखिए।
उत्तर:
सन् 1932 में चैडविक ने बतलाया कि जब बेरीलियम पर a कणों की बमबारी की जाती है तो एक नया कण प्राप्त होता है, यह कण उदासीन होता है अर्थात् इस पर कोई आवेश नहीं होता है। इसका द्रव्यमान प्रोटॉन के बराबर होता है। इसे न्यूट्रॉन कहते हैं।
लक्षण:
- नाभिक में उपस्थित आवेशहीन कण है।
- न्यूट्रॉन का द्रव्यमान प्रोटॉन के द्रव्यमान के बराबर 1.6749 x 10-27 kg या 1.00893 a.m.u. है।
प्रश्न 6.
परमाणु क्रमांक एवं द्रव्यमान संख्या में अंतर लिखिये।
उत्तर:
परमाणु क्रमांक एवं द्रव्यमान संख्या में अंतर –
परमाणु क्रमांक
- परमाणु क्रमांक परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या है।
- इसे Z से दर्शाते हैं।
द्रव्यमान संख्या
- द्रव्यमान संख्या परमाणु के नाभिक में प्रोटॉन एवं न्यूट्रॉनों की संख्या का योग है।
- इसे A से दर्शाते हैं।
प्रश्न 7.
परमाणु कक्षक किसे कहते हैं?
उत्तर:
नाभिक के चारों ओर का वह त्रिविम क्षेत्र है जहाँ इलेक्ट्रॉनों के पाये जाने की प्रायिकता अधिकतम रहती है, परमाणु कक्षक कहलाता है।
प्रश्न 8.
α – कण किसे कहते हैं?
उत्तर:
α – कण को 2He4 से दर्शाते हैं क्योंकि α – कण हीलियम नाभिक है जिस पर 2 इकाई धन आवेश होता है तथा इसका द्रव्यमान He नाभिक के बराबर 4 इकाई होता है।
प्रश्न 9.
रदरफोर्ड.परमाणु मॉडल में a-कण के प्रत्यावर्तन से क्या निष्कर्ष है?
उत्तर:
- अधिकांश α – कण स्वर्णपत्र के आर-पार सीधी रेखा से निकल जाते हैं। अतः परमाणु में नाभिक तथा इलेक्ट्रॉनों के बीच का स्थान लगभग रिक्त रहता है।
- कुछ α – कण स्वर्णपत्र से टकराने के पश्चात् विचलित हो जाते हैं क्योंकि परमाणु के भीतर एक धनावेशित केन्द्र होता है।
- 20,000 α – कण में एक a-कण नाभिक से टकराकर वापस आता है क्योंकि परमाणु के आकार की तुलना में नाभिक बहुत छोटा एवं दृढ़ होता है।
प्रश्न 10.
रदरफोर्ड के परमाणु मॉडल में कौन-सी कमियाँ हैं?
उत्तर:
सन् 1913 में नील्स बोर ने रदरफोर्ड के परमाणु मॉडल को निम्नांकित कारणों से दोषपूर्ण बताया –
1. विद्युत् चुम्बकीय सिद्धान्त के अनुसार जब कोई आवेशित कण किसी परिपथ में भ्रमण करता है तो वह विकिरणों के रूप में कुछ ऊर्जा मुक्त करता है। इसी प्रकार इलेक्ट्रॉन नाभिक के चारों ओर कक्षीय गति करेगा तो उसकी ऊर्जा धीरे-धीरे विकिरणों के रूप में मुक्त होगी और इलेक्ट्रॉन धीरे-धीरे नाभिक के समीप आ जायेगा और अंत में यह नाभिक में समाहित हो जायेगा। इस प्रकार परमाणु अस्थायी होगा जबकि वास्तव में ऐसा नहीं होता।
2. इस मॉडल के अनुसार परमाण्वीय स्पेक्ट्रम सतत् होना चाहिये जबकि प्रयोगों द्वारा स्पष्ट है कि रेखाएँ प्राप्त होती हैं।
3. इस मॉडल के आधार पर विभिन्न कोशों में उपस्थित इलेक्ट्रॉनों की संख्या को नहीं दर्शाया जा सकता है।
प्रश्न 11.
विद्युत् चुम्बकीय तरंगें क्या हैं?
उत्तर:
किसी उच्च आवृत्ति वाली प्रत्यावर्ती धारा में से विकिरणों के रूप में ऊर्जा उत्सर्जित होती है जो एक प्रकार के तरंगों के समान होती है तथा इसका वेग प्रकाश के वेग के समान होता है। ये तरंगें विद्युत् तथा चुम्बकीय क्षेत्रों के दोलन के कारण उत्पन्न होती हैं। इसलिये इन्हें विद्युत् चुम्बकीय तरंगें कहते हैं।
प्रश्न 12.
परमाणु का नाभिक α – कणों को प्रतिकर्षित करता है, क्यों?
उत्तर:
प्रत्येक α – कण पर 2 इकाई धन आवेश होता है। प्रत्येक परमाणु के केन्द्र में धन आवेशित नाभिक होता है। हम जानते हैं कि समान आवेश एक-दूसरे को प्रतिकर्षित करते हैं इसलिए परमाणु का नाभिक α – कणों को प्रतिकर्षित करते हैं।
प्रश्न 13.
ऐनोड किरणों तथा कैथोड किरणों में अंतर लिखिए।
उत्तर:
ऐनोड किरणों तथा कैथोड किरणों में अंतर –
ऐनोड किरणे:
- यह धन आवेशित कणों से मिलकर बनी होती है।
- ऐनोड किरणों की प्रकृति विसर्जन नली में ली गई गैस की प्रकृति पर निर्भर करती है।
- ऐनोड किरणों में उपस्थित कणों का द्रव्यमान – विसर्जन नली में ली गई गैस के परमाणु के द्रव्यमान के बराबर होता है।
कैथोड किरणें:
- यह ऋण आवेशित कणों से मिलकर बनी होती है।
- कैथोड किरणों की प्रकृति विसर्जन नली में ली गई गैस की प्रकृति पर निर्भर नहीं करती।
- कैथोड किरणों में उपस्थित कणों का द्रव्यमान नगण्य होता है।
प्रश्न 14.
निम्नलिखित में से कौन-सा कक्षक उच्च प्रभावी नाभिकीय आवेश अनुभव करेगा –
- 25 और 3s
- 4d और 4f
- 3d और 3p
उत्तर:
- 2s कक्ष के अधिक समीप है अत: यह कक्षक उच्च प्रभावी नाभिकीय आवेश अनुभव करेगा।
- 4d कक्षक उच्च प्रभावी नाभिकीय आवेश अनुभव करेगा।
- 3p कक्षक उच्च प्रभावी नाभिकीय आवेश अनुभव करेगा।
प्रश्न 15.
3p कक्षक में उपस्थित कोणीय नोड तथा त्रिज्य नोडों की कुल संख्या ज्ञात कीजिए।
हल:
3p कक्षक के लिए-मुख्य क्वाण्टम संख्या n = 3 तथा
दिगंशी क्वाण्टम संख्या l = 1
कोणीय नोड की संख्या = l = 1
त्रिज्य नोडों की संख्या = n – l – 1 = 3 – 1 – 1 = 1
प्रश्न 16.
परमाणु और आयन में क्या अंतर है?
उत्तर:
परमाणु और आयन में अंतर –
परमाणु:
- यह पूर्णतः उदासीन होता है।
- इसमें प्रोटॉनों और इलेक्ट्रॉनों की संख्या समान होती है।
- परमाणु अस्थायी होता है तथा रासायनिक अभिक्रिया में भाग लेता है।
आयन:
- यह धन आवेशित या ऋण आवेशित होता है।
- इसमें प्रोटॉनों और इलेक्ट्रॉनों की संख्या समान नहीं होती है।
- आयन विलयन अवस्था में स्थायी होता है।
प्रश्न 17.
विद्युत् चुम्बकीय स्पेक्ट्रम क्या है?
उत्तर:
विभिन्न प्रकार के विद्युत् चुम्बकीय विकिरणों को उनकी आवृत्ति या तरंगदैर्घ्य के बढ़ते या घटते क्रम में व्यवस्थित करने से जो ग्राफ प्राप्त होता है उसे विद्युत् चुम्बकीय स्पेक्ट्रम कहते हैं ।
प्रश्न 18.
द्रव्य तरंगें विद्युत् चुम्बकीय तरंगों से भिन्न हैं। समझाइये।
उत्तर:
द्रव्य तरंगें विद्युत् चुम्बकीय तरंगों से निम्न प्रकार भिन्न हैं –
- इनके तरंगदैर्घ्य का मान विद्युत् चुम्बकीय तरंगों की तुलना में कम होता है।
- इनका वेग विद्युत् चुम्बकीय तरंगों की तुलना में कम है।
- द्रव्य तरंगें किसी कण से उत्सर्जित नहीं होतीं बल्कि कण के साथ सम्बद्ध होती हैं।
प्रश्न 19.
इलेक्ट्रॉन अपने निश्चित कक्षाओं में ही घूमते हैं। क्यों?
उत्तर:
गतिशील एवं आवेशयुक्त इलेक्ट्रॉन एक ऊर्जा स्तर से दूसरे ऊर्जा स्तर में जाने पर ऊर्जा का विकिरण या अवशोषण करते हैं जिसके फलस्वरूप परमाणु अस्थिर हो जाता है। परमाणु को स्थायित्व देने हेतु इलेक्ट्रॉन विशिष्ट कक्षाओं में घूमते हैं।
प्रश्न 20.
एक गतिशील इलेक्ट्रॉन के द्वारा कण एवं तरंग, दोनों की प्रकृति दर्शाई जाती है। कारण स्पष्ट कीजिये।
उत्तर:
इलेक्ट्रॉन की कणीय प्रकृति के कारण इसका एक निश्चित संवेग होता है तथा गतिशील होने के कारण यह तरंग गुण दर्शाता है। इस प्रकार इलेक्ट्रॉन दोनों गुण एक साथ दर्शाता है।
प्रश्न 21.
तीव्र गतिशील इलेक्ट्रॉन की स्थिति और वेग को एक साथ ज्ञात करना असंभव है, क्यों?
उत्तर:
इलेक्ट्रॉन एक अतिसूक्ष्म कण है। अतः उसे कम तरंगदैर्घ्य वाले प्रकाश जैसे, किरण या एक्स किरणों से ही देखा जा सकता है। इलेक्ट्रॉनों को देखने के लिये यह आवश्यक है कि फोटॉन इलेक्ट्रॉन से टकराकर वापिस आये। लेकिन इलेक्ट्रॉन का फोटॉन से टकराने के पश्चात् वेग बदल जाता है। इसलिये इलेक्ट्रॉन की स्थिति और वेग को एक साथ ज्ञात करना संभव नहीं है।
प्रश्न 22.
क्रोमियम का इलेक्ट्रॉनिक विन्यास 4s23d4 के स्थान पर 4s13d5 लिखा जाता है, क्यों?
उत्तर:
क्रोमियम का सामान्य अवस्था में इलेक्ट्रॉनिक विन्यास [Ar] 4s23d4 होना चाहिये परन्तु 3d4 के.यदि 4 इलेक्ट्रॉन हों तो यह 3d कक्षक अपूर्ण कक्षक के रूप में होगा तथा अस्थायित्व को दर्शाता है। यदि 4s का एक इलेक्ट्रॉन उत्तेजित होकर 3d कक्षक में चला जाता है तो 4s तथा 3d कक्षक दोनों कक्षक अर्धपूर्ण कक्षक है जो स्थायित्व को दर्शाते हैं इसलिये क्रोमियम का इलेक्ट्रॉनिक विन्यास 4s23d4 के स्थान पर 4s13d5 लिखा जाता है।
प्रश्न 23.
कॉपर का इलेक्ट्रॉनिक विन्यास 4s23d1 सही क्यों नहीं है?
उत्तर:
कॉपर का सामान्य अवस्था में इलेक्ट्रॉनिक विन्यास [Ar] 4s23d9 है। d कक्षक में 9 इलेक्ट्रॉन हैं जो अपूर्ण कक्षक है तथा अस्थायी है। यदि 4s का एक इलेक्ट्रॉन उत्तेजित होकर 3d कक्षक में चला जाता है तो 4s अर्धपूर्ण तथा 3d कक्षक पूर्णकक्षक है जो अधिक स्थायी है इसलिये कॉपर का इलेक्ट्रॉनिक विन्यास 4s23d9 के स्थान पर 4s13d10 लिखा जाता है।
प्रश्न 24.
मैक्स प्लांक का क्वाण्टम सिद्धान्त लिखिए।
उत्तर:
मैक्स प्लांक का क्वाण्टम सिद्धान्त –
1. किसी परमाणु या अणु द्वारा विकरित ऊर्जा का अवशोषण या उत्सर्जन सतत् न होकर निश्चित ऊर्जा के बण्डलों या पैकेटों से होता है जिन्हें क्वाण्टम कहते हैं।
2. प्रत्येक क्वाण्टम से सम्बद्ध ऊर्जा विकिरण की आवृत्ति के समानुपाती होती है।
Ε ∝ ν
E = hν, जहाँ h = प्लांक स्थिरांक है।
3. कोई भी अणु या परमाणु क्वाण्टम के सरल गुणांकों में ही ऊर्जा अवशोषित या उत्सर्जित करती है।
प्रश्न 25.
परमाणु के मौलिक कण क्या हैं? इनके नाम, द्रव्यमान आवेश सहित लिखिये।
उत्तर:
परमाणु तीन प्रकार के कणों से मिलकर बना है, जिन्हें मूलभूत कण या मौलिक कण कहते हैं।
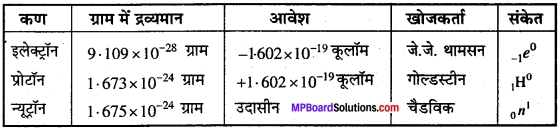
प्रश्न 26.
फोटॉन किसे कहते हैं?
उत्तर:
विकरित ऊर्जा कणिकाओं को फोटॉन कहते हैं अर्थात् प्रकाश के लिये विकिरण का क्वाण्टम hν एक फोटॉन कहलाता है। ये द्रव्यमान रहित कणिकाओं के पैकेट या बण्डल होते हैं।
प्रश्न 27.
समरफील्ड के परमाणु मॉडल की प्रमुख विशेषताएँ लिखिये।
उत्तर:
समरफील्ड के परमाणु मॉडल की प्रमुख विशेषताएँ निम्नलिखित हैं –
- इलेक्ट्रॉन वृत्तीय कक्षाओं के साथ-साथ दीर्घवृत्तीय कक्षाओं में घूमते हैं जहाँ दो त्रिज्यायें होती हैं।
- कक्षाएँ उप कक्षाओं से मिलकर बनी होती हैं।
- किसी कक्षा में उप-कक्षाओं की संख्या क्वाण्टम संख्या n के बराबर होती है।
प्रश्न 28.
क्वाण्टम किसे कहते हैं?
उत्तर:
मैक्स प्लांक के क्वाण्टम सिद्धांत के अनुसार किसी परमाणु या अणु से ऊर्जा का अवशोषण या उत्सर्जन सतत् रूप से न होकर सूक्ष्म पैकेट या क्वाण्टा के रूप में ऊर्जा का संचरण होता है और इस ऊर्जा के अवशोषण या उत्सर्जन 1s , का मात्रक क्वाण्टम कहलाता है।
प्रश्न 29.
ऑफबाऊ का नियम लिखिये।
उत्तर:
ऑफबाऊ एक जर्मन शब्द है जिसका अर्थ क्रमिक रचना या रचना करना है। इस नियम के अनुसार, किसी बहु – ‘इलेक्ट्रॉन वाले परमाणु के विभिन्न कक्षकों में इलेक्ट्रॉन बढ़ती हुई ऊर्जा या घटते हुये स्थायित्व के क्रम में प्रवेश करते हैं। अर्थात् इलेक्ट्रॉन पहले निम्न ऊर्जा वाले कक्षक में जाता है फिर उपयुक्त ऊर्जा स्तर द्वारा उच्च ऊर्जा स्तर वाले कक्षक में चला जाता है।
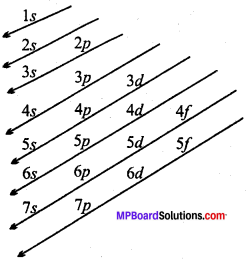
विभिन्न उपकोशों के लिये बढ़ती हुई ऊर्जा का क्रम निम्नलिखित है –
is 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
प्रश्न 30.
जीमेन प्रभाव क्या है?
उत्तर:
जीमेन के अनुसार स्पेक्ट्रमी रेखाएँ उत्सर्जित करने वाले स्रोत पर चुम्बकीय क्षेत्र लगाने पर स्पेक्ट्रम की रेखाएँ अनेक सूक्ष्म रेखाओं में विभाजित हो जाती हैं, इस घटना को जीमेन प्रभाव कहते हैं।
प्रश्न 31.
क्लोरीन के अंतिम इलेक्ट्रॉन व अयुग्मित इलेक्ट्रॉन के लिये चारों क्वाण्टम संख्याओं के मान लिखिये।
उत्तर:
![]()
Cl17, = 1s2 2s2 2p6 3s2 3p5
अंतिम इलेक्ट्रॉन हेतु, n = 3, l = 1, m = 0, s = –\(\frac{1}{2}\)
अयुग्मित इलेक्ट्रॉन हेतु,
n = 3, l = 1, m = +1, s = +\(\frac{1}{2}\)
परमाणु की संरचना लघु उत्तरीय प्रश्न
प्रश्न 1.
पॉउली का अपवर्जन नियम उदाहरण सहित लिखिए। इसकी उपयोगिता भी लिखिए।
उत्तर:
पॉउली का अपवर्जन नियम-“किसी भी परमाणु में किन्हीं दो इलेक्ट्रॉनों की चारों क्वाण्टम संख्याएँ समान नहीं हो सकती। दूसरे शब्दों में, एक ही परमाणु के किन्हीं दो इलेक्ट्रॉनों की तीन क्वाण्टम संख्याएँ समान हो सकती हैं परन्तु चौथी चक्रण क्वाण्टम संख्या अवश्य भिन्न होगी। अर्थात् किसी भी कक्षक में विपरीत चक्रण वाले केवल दो इलेक्ट्रॉन रह सकते हैं।”
उदाहरण:

महत्व:
- परमाणु के विभिन्न मुख्य ऊर्जा स्तरों, उप ऊर्जा स्तरों में इलेक्ट्रॉनों की अधिकतम संख्या और विभिन्न इलेक्ट्रॉनों की क्वाण्टम संख्याओं की गणना कर सकते हैं।
- इस नियम से परमाणु संरचना को काफी स्पष्ट रूप से समझाया जा सकता है।
प्रश्न 2.
हुण्ड के अधिकतम बहुलता के नियम को उदाहरण सहित समझाइये।
उत्तर:
हुण्ड के नियम के अनुसार, “किसी भी उपकोश के कक्षकों में इलेक्ट्रॉनों के जोड़े तब तक नहीं बनते हैं जब तक कि उस उपकोश के समस्त कक्षकों में एक-एक इलेक्ट्रॉन नहीं चला जाता है।” दूसरे शब्दों में, समान ऊर्जा के कक्षकों में इलेक्ट्रॉनों का युग्मन तभी होता है जब आने वाले इलेक्ट्रॉन के लिये कोई रिक्त कक्षक न मिले। अर्थात् किसी भी उपकोश के कक्षक में इलेक्ट्रॉन इस प्रकार से भरते हैं कि समान चक्रण के अयुग्मित इलेक्ट्रॉनों की संख्या अधिकतम हो।

प्रश्न 3.
डी-ब्रॉग्ली की संकल्पना लिखिए।
उत्तर:
डी-ब्रॉग्ली ने इलेक्ट्रॉन के तरंग स्वरूप को प्रतिपादित किया, जिसके अनुसार “प्रत्येक गतिशील सूक्ष्म कण तरंग के गुण प्रदर्शित करता है।” प्लांक के क्वाण्टम सिद्धान्त के अनुसार,
E = hν …(1)
आइन्स्टीन के द्रव्यमान ऊर्जा संबंध से,
∴ E = mc2 …..(2)
समी. (1) और (2) से,
mc2 = hν
⇒ mc = h\(\frac{c}{λ}\)
⇒ mc = \(\frac{h}{λ}\)
⇒ λ = \(\frac{h}{mc}\)
कण की प्रकृति तरंग जैसी है इसलिये c को v से प्रतिस्थापित किया जा सकता है। यदि m संहति वाला कण v वेग से गतिमान है तो
λ = \(\frac{h}{mv}\) …(3)
अतः λ = \(\frac{h}{p}\) [mv = p] …(4)
अतः समी. (4) से स्पष्ट है किसी गतिशील कण का तरंगदैर्घ्य उसके संवेग पर निर्भर करता है।
प्रश्न 4.
आप कैसे सिद्ध करोगे कि अतिसूक्ष्म कण जैसे इलेक्ट्रॉन द्वैती प्रकृति दर्शाते हैं?
उत्तर:
कणीय प्रकृति:
जब कोई अतिसूक्ष्म कण जैसे इलेक्ट्रॉन जिंक सल्फाइड के पर्दे पर टकराता है, तो उसका एक धब्बा बन जाता है, इस प्रकार जितने इलेक्ट्रॉन पर्दे पर टकराते हैं उतने धब्बे पर्दे पर बन जाते हैं तथा ये धब्बे स्थानीकृत होते हैं और तरंग के समान पूरे क्षेत्र में फैलते नहीं हैं।
तरंग प्रकृति:
डेविसन और जर्मर ने अपने प्रयोग में निकिल के क्रिस्टल पर इलेक्ट्रॉनों के एक किरण पुंज को भेजा और यह देखा कि ये किरणें क्रिस्टल से ठीक उस प्रकार उस कोण पर विवर्तित होती है जिस पर ब्रैग समीकरण के अनुसार प्रकाश की किरणें होती हैं।
इससे सिद्ध होता है कि इलेक्ट्रॉन कणीय एवं तरंग दोनों प्रकृति दर्शाता है, इसे पदार्थ की द्वैती प्रकृति कहते हैं।
प्रश्न 5.
कैथोड किरणों के प्रमुख गुण लिखिए।
उत्तर:
कैथोड किरणों के गुण:
- कैथोड किरणें प्रकाश के वेग से सरल रेखा में गमन करती हैं।
- कैथोड किरणों के मार्ग में यदि विद्युत् क्षेत्र लगाया जाये तो ये धनावेशित क्षेत्र की ओर विक्षेपित हो जाती हैं।
- इनके मार्ग में हल्का पैडल चक्र रख दिया जाये तो वह घूमने लगता है जो किरणों में उपस्थित तीव्र गतिज ‘ऊर्जा वाले कणों के कारण होता है।
- ये किरणें गैसों को आयनित कर देती हैं।
- ये किरणें धातुओं जैसे, टंगस्टन से टकराकर X-किरणें उत्पन्न करती हैं।
- ये किरणें फोटोग्राफिक प्लेट को प्रभावित करती हैं।
प्रश्न 6.
इलेक्ट्रॉन के प्रमुख गुण लिखिये।
उत्तर:
इलेक्ट्रॉन के गुण:
- सभी गैसों में ऋण आवेश युक्त कण उपस्थित हैं जो विसर्जन नली में 10-4 वायुमण्डलीय दाब पर गैस पर उच्च वोल्टता पर कैथोड से उत्पन्न होते हैं।
- इलेक्ट्रॉन को -1e0 से दर्शाते हैं।
- इलेक्ट्रॉन का द्रव्यमान हाइड्रोजन के द्रव्यमान का \(\frac{1}{1837}\) वाँ भाग होता है तथा प्रत्येक इलेक्ट्रॉन का द्रव्यमान 9.1 x 10-28 gm या 9.1 x 10-31 kg है।
- प्रत्येक इलेक्ट्रॉन का आवेश 1.60 x 10-19 कूलॉम होता है।
प्रश्न 7.
ऐनोड किरणें कैसे उत्पन्न होती हैं? उसके गुण लिखिए।
उत्तर:
गोल्डस्टीन:
गोल्डस्टीन ने सन् 1886 में क्रुक्स नली में छिद्रित कैथोड लगाकर न्यून दाब पर गैस में विद्युत् विसर्जन करने पर पाया कि कैथोड किरणें निकलने के कुछ समय पश्चात् ऐनोड से अदृश्य किरणें निकलकर छिद्रित कैथोड की ओर गमन करती हैं। इन किरणों को ऐनोड किरणें या केनाल किरणें कहते हैं।
ऐनोड किरणों के गुण:
- ऐनोड किरणें सरल रेखा में गमन करती हैं।
- ऐनोड किरणों के मार्ग में यदि विद्युत् क्षेत्र लगाया जाये तो ये ऋण आवेशित क्षेत्र की ओर मुड़ जाती हैं।
- ऐनोड किरणें अपने पथ में रखे हुए पैडल चक्र में यांत्रिक गति उत्पन्न करती हैं।
- विसर्जन नली में अलग-अलग गैस ली जाये तो प्रत्येक दशा में प्राप्त ऐनोड कणों की संहति अलग-अलग होती है।
प्रश्न 8.
प्रोटॉन के लक्षण लिखिए।
उत्तर:
प्रोटॉन के लक्षण:
- विसर्जन नली में अलग-अलग गैसें लेने पर अलग-अलग द्रव्यमान वाले धनात्मक कण मिलते हैं। हाइड्रोजन गैस से मिलने वाले धनात्मक कण प्रोटॉन कहलाते हैं। इनका द्रव्यमान सबसे कम है।
- प्रोटॉन को 1H1 से दर्शाते हैं।
- प्रोटॉन का द्रव्यमान 1.67 x 10-24 gm या 1.67 x 10-27 kg होता है।
- प्रोटॉन पर आवेश 1.6 x 10-19 कूलॉम होता है।
प्रश्न 9.
परमाणु के विभिन्न कोशों में इलेक्ट्रॉन भरे जाने की बोर-बरी व्यवस्था लिखिए।
उत्तर:
परमाणु के कोशों में इलेक्ट्रॉनों के भरे जाने की क्रमिक व्यवस्था बोर-बरी वैज्ञानिक द्वारा दी गई है –
- किसी कक्षा n में इलेक्ट्रॉनों की संख्या अधिकतम 2n होगी।
- अंतिम कक्षा में 8 और अंतिम से दूसरी कक्षा में 18 से अधिक इलेक्ट्रॉन नहीं होंगे।
- अंतिम कक्षा में 2 से अधिक और अंतिम से दूसरी कक्षा में 9 से अधिक इलेक्ट्रॉन उसी समय हो सकते हैं जब पहले की कक्षायें नियमानुसार भर चुकी हों।
- अंतिम कक्षा में 8 इलेक्ट्रॉन हो जाने पर अगली कक्षा में इलेक्ट्रॉन भरे जाते हैं।
- यह आवश्यक नहीं कि किसी कक्षा में जब तक 2n के नियम के अनुसार इलेक्ट्रॉन पूरे न हो जाये तभी अगली कक्षा में इलेक्ट्रॉन प्रवेश करेंगे।
प्रश्न 10.
कक्षकों के स्थायित्व से क्या समझते हैं?
उत्तर:
अर्धपूर्ण एवं पूर्ण कक्षकों में इलेक्ट्रॉनों का वितरण सममित होता है और यह सममिति कक्षकों को अतिरिक्त स्थायित्व प्रदान करती है। किसी परमाणु के समान ऊर्जा वाले कक्षकों के मध्य इलेक्ट्रॉनों का विनिमय होता रहता है तथा इस प्रक्रम के दौरान ऊर्जा मुक्त होती है जिसके फलस्वरूप कक्षक स्थायित्व प्राप्त कर लेता है। कक्षक के अर्धपूर्ण या पूर्ण भरे होने पर इलेक्ट्रॉनों के विनिमय की सम्भावना अधिकतम रहती है। इसलिये ये कक्षक अधिक स्थायी होते हैं।
प्रश्न 11.
समस्थानिक तथा समभारिक में अंतर लिखिये।
उत्तर:
समस्थानिक तथा समभारिक में अंतर –
समस्थानिक
- एक ही तत्व के विभिन्न परमाणु जिनके परमाणु क्रमांक समान किन्तु परमाणु भार भिन्न हैं, समस्थानिक कहलाते हैं।
- नाभिक में उपस्थित प्रोटॉनों की संख्या समान किन्तु न्यूट्रॉन की संख्या भिन्न होती है।
- रासायनिक गुणों में समानता होती है।
- बाहरी कोश में उपस्थित इलेक्ट्रॉनों की संख्या भिन्न होती है।
समभारिक:
- विभिन्न तत्वों के विभिन्न परमाणु जिनके परमाणु भार समान किन्तु परमाणु क्रमांक भिन्न हैं, समभारिक कहलाते हैं।
- नाभिक में उपस्थित प्रोटॉनों की संख्या तथा न्यूट्रॉनों की संख्या भिन्न होती है।
- रासायनिक गुणों में भिन्नता होती है।
- बाहरी कोश में उपस्थित इलेक्ट्रॉनों की संख्या समान होती है।
प्रश्न 12.
बोर के परमाणु मॉडल के प्रमुख अभिगृहीत लिखिए।
उत्तर:
बोर के परमाणु मॉडल के प्रमुख अभिगृहीत निम्नलिखित हैं –
1. परमाणु एक अतिसूक्ष्म कण है, जिसके केन्द्र में नाभिक स्थित है और नाभिक के चारों ओर इलेक्ट्रॉन बंद वृत्तीय कक्षाओं में चक्कर लगाते रहते हैं, जिन्हें कोश भी कहते हैं।
2. परमाणु नाभिक के चारों ओर अनेक वृत्ताकार कक्षाएँ संभव हैं किन्तु इलेक्ट्रॉन कुछ विशिष्ट कक्षाओं में ही घूम सकते हैं जिनमें घूमने से इलेक्ट्रॉन की ऊर्जा में कोई हानि नहीं होती।
3. ईलेक्ट्रॉन केवल उन्हीं कक्षाओं में घूमते हैं जिनमें उनका कोणीय संवेग \(\frac{h}{2π}\) या उनका सरल गुणांक होता है। इन कक्षाओं को स्थायी कक्षक कहते हैं। यदि इलेक्ट्रॉन का द्रव्यमान m, कक्षा की त्रिज्या r तथा इलेक्ट्रॉन का वेग v हो तो –
mvr = \(\frac{nh}{2π}\) जहाँ n = 1, 2, 3
4. इलेक्ट्रॉन सामान्यतः अपनी ऊर्जा के अनुरूप वाली कक्षा में ही चक्कर लगाता रहता है, किन्तु जब यह बाहर से ऊर्जा अवशोषित कर लेता है तो यह कूदकर उच्च ऊर्जा वाली कक्षा में चला जाता है। यहाँ 10-8 सेकण्ड ठहरकर तुरन्त निम्न ऊर्जा वाली कक्षा में आ जाता है तथा वापस लौटते समय इलेक्ट्रॉन विद्युत् चुम्बकीय तरंगों के रूप में ऊर्जा उत्सर्जित करता है।
5. स्थायी कक्षाओं की ऊर्जा निश्चित होती है। इन कक्षाओं को ऊर्जा स्तर कहते हैं तथा नाभिक से बाहर की ओर इनका क्रम रहता है। इन ऊर्जा स्तरों में घूमने वाले इलेक्ट्रॉन ऊर्जा का उत्सर्जन नहीं करते।
प्रश्न 13.
कक्ष और कक्षक में अंतर लिखिए।
उत्तर:
कक्ष और कक्षक में अंतर:
कक्ष:
- नाभिक के चारों ओर निश्चित वृत्ताकार पथ जिस पर इलेक्ट्रॉन गमन करता है कक्ष कहलाता है।
- सभी कक्ष वृत्ताकार होते हैं।
- कक्ष अदिशात्मक होते हैं।
- यह इलेक्ट्रॉन की द्विविमीय गति को दर्शाता है।
- कोश के इलेक्ट्रॉनों की अधिकतम संख्या 2n2 होती है।
कक्षक:
- नाभिक के चारों ओर त्रिविमीय क्षेत्र है जहाँ इलेक्ट्रॉन के पाये जाने की प्रायिकता अधिकतम होती है।
- s कक्षक के अलावा विभिन्न कक्षकों का आकार अलग-अलग होता है।
- s कक्षक को छोड़कर सभी दिशात्मक होते हैं।
- यह इलेक्ट्रॉन की त्रिविमीय गति को दर्शाता है।
- किसी कक्षक में अधिकतम दो इलेक्ट्रॉन हो सकते हैं।
प्रश्न 14.
(n + 1) नियम क्या है?
उत्तर:
1. विभिन्न कक्षकों में इलेक्ट्रॉन (n + 1) नियम के अनुसार भरते हैं जहाँ n मुख्य क्वाण्टम संख्या तथा l दिगंशी क्वाण्टम संख्या है। इस नियम के अनुसार नया इलेक्ट्रॉन उस कक्षक में पहले प्रवेश करता है जिसके लिये n + 1 का मान सबसे कम होता है।
उदाहरण:
2s और 2p के लिये n + 1 के मान क्रमशः 2 और 3 हैं। अतः इलेक्ट्रॉन पहले 25 उपकोश में प्रवेश करेगा।
2. यदि दो या दो से अधिक कक्षकों के लिये n + 1 का मान समान हो तो नया आने वाला इलेक्ट्रॉन उस कक्षक में प्रवेश करता है जिसके लिये n का मान न्यूनतम होता है।
उदाहरण:
4p और 3d दोनों उपकोशों के लिये n + 1 का मान 5 है। लेकिन 3d के लिये n का मान कम है। इसलिये 3d उपकोश में इलेक्ट्रॉन पहले प्रवेश करेगा।
प्रश्न 15.
बोर सिद्धान्त के मुख्य दोष क्या हैं?
उत्तर:
बोर सिद्धान्त के मुख्य दोष निम्नलिखित हैं –
- बोर के सिद्धान्त के द्वारा एक से अधिक इलेक्ट्रॉन वाले परमाणुओं के स्पेक्ट्रम की व्याख्या नहीं की जा सकती है।
- बोर के सिद्धान्त के अनुसार इलेक्ट्रॉन की कक्षाओं को वृत्ताकार माना गया है जबकि कक्षाएँ दीर्घ वृत्ताकार भी होती हैं।
- यह हाइजेनबर्ग के अनिश्चितता सिद्धान्त की व्याख्या नहीं करता।
- यह इलेक्ट्रॉन की द्वैती प्रकृति का स्पष्टीकरण नहीं करता है।
प्रश्न 16.
हाइजेनबर्ग का अनिश्चितता का सिद्धान्त क्या है? इसका गणितीय रूप लिखिए।
उत्तर:
इस सिद्धान्त के अनुसार इलेक्ट्रॉन जैसे गतिमान अति सूक्ष्म कण की स्थिति तथा संवेग का एक साथ सही निर्धारण करना संभव नहीं है। यदि एक को निश्चितता के साथ निर्धारित कर लिया जाये तो दूसरे का निर्धारण करना अनिश्चित हो जाता है।
गणितीय रूप:
∆x × ∆p ≥ \(\frac{h}{4π}\)
∆x × m∆v ≥ \(\frac{h}{4π}\)
जहाँ ∆x = स्थिति में अनिश्चितता
∆p = संवेग में अनिश्चितता
h = प्लांक स्थिरांक है।
इस समीकरण के अनुसार गतिशील सूक्ष्म कण की स्थिति की अनिश्चितता और संवेग की अनिश्चितता विपरीत अनुपात में होते हैं। यदि एक का मान कम हो तो दूसरे का मान अधिक होगा।
प्रश्न 17.
ऑफबाऊ सिद्धान्त के आधार पर निम्नलिखित परमाणुओं की मूल अवस्था में इलेक्ट्रॉनिक विन्यास लिखिए –
- निऑन (Z = 10)
- फॉस्फोरस (Z = 15)
- क्लोरीन (Z = 17)
- पोटैशियम (Z = 19)
उत्तर:
- निऑन (Z = 10) – 1s2 2s2 2px2, 2py2, 2pz2
- फॉस्फोरस (Z = 15) – 1s2 2s2 2p6 3s2 3px1 3py1, 3pz1
- क्लोरीन (Z = 17) – 1s2 2s2 2p6 3s2 3px2 3py2 3pz2
- पोटैशियम (Z = 19) – 1s2 2s2 2p6 3s2 3p6 4s1.
प्रश्न 18.
निम्न इलेक्ट्रॉनिक विन्यासों में हुण्ड का नियम प्रदर्शित कीजिए –
1. 8O+2
2. 7N-3
3. 6C-1
उत्तर:

प्रश्न 19.
3px, 4py तथा 5pz कक्षक में यदि एक-एक इलेक्ट्रॉन हो तो उनके लिये चारों क्वाण्टम संख्या के मान ज्ञात कीजिए।
उत्तर:
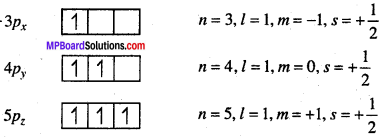
प्रश्न 20.
क्लोरीन परमाणु के 17वें तथा Fe के 26 वें इलेक्ट्रॉन के लिये चारों क्वाण्टम संख्याओं के मान लिखिये।
उत्तर:

प्रश्न 21.
इलेक्ट्रॉन का – मान किसने ज्ञात किया तथा कैसे ज्ञात किया?
उत्तर:
इलेक्ट्रॉन के \(\frac{e}{m}\) मान का निर्धारण सर जे.जे थॉमसन द्वारा किया गया। सर थॉमसन द्वारा इलेक्ट्रॉन के आवेश (e) तथा द्रव्यमान (m) का निर्धारण करने के लिये ऐनोड से आगे पहुँचने पर सीधी रेखाओं में चलने वाली किरण पुंज का चुनाव करने के लिये किरणों को एक गोल डिस्क से गुजरने दिया जाता है। किरणों पर आरोपित चुम्बकीय क्षेत्र एवं विद्युत् क्षेत्र की दिशाएँ एक-दूसरे के लम्बरूप तथा किरणों की गति की दिशा के भी लम्बरूप होती हैं तथा किरणों के विक्षेपण को मापकर कण के आवेश (e) तथा द्रव्यमान (m) का अनुपात ज्ञात किया जाता है। \(\frac{e}{m}\) का मान 1.76 x 108 कूलॉम/ग्राम प्राप्त होता है।
प्रश्न 22.
प्राकृतिक रेडियो ऐक्टिवता क्या है? समझाइये।
उत्तर:
प्रो. हेनरी बेकरल ने सन् 1898 में पाया कि यूरेनियम तथा उनके यौगिकों में एक विशिष्ट गुण होता है। इन पदार्थों से लगातार अदृश्य किरणों का उत्सर्जन होता है, जो जिंक सल्फाइड की प्लेट पर टकराकर प्रतिदीप्ति उत्पन्न करती है तथा x-किरणों की तरह फोटोग्राफिक प्लेट को प्रभावित करती है व गैसों को आयनित कर देती है तथा ये किरणें पतले धातु की चादरों को बेधने की क्षमता रखते हैं। इन किरणों को बेकरल किरणें कहा गया। मैडम क्यूरी ने इन किरणों को रेडियोएक्टिव किरणें तथा इस गुण को रेडियो ऐक्टिवता कहा। अतः “वह पदार्थ जिनमें इस प्रकार सक्रिय अदृश्य किरणों को उत्सर्जित करने का गुण होता है रेडियो ऐक्टिव पदार्थ कहलाते हैं तथा यह गुण रेडियो ऐक्टिवता कहलाता है।”
प्रश्न 23.
कोश, उपकोश व कक्षक में अंतर समझाइये।
उत्तर:
कोश:
किसी परमाणु में नाभिक के चारों ओर वह निश्चित वृत्ताकार पथ जिस,पर इलेक्ट्रॉन गमन करते हैं कक्ष या कोश कहलाते हैं। बोर के सिद्धान्त के अनुसार इलेक्ट्रॉन केवल उन्हीं कक्षाओं में गमन करते हैं जिनका कोणीय संवेग (mvr) का मान \(\frac{h}{2π}\) या उसके सरल गुणांक के बराबर होता है। इसे मुख्य क्वाण्टम संख्या द्वारा दर्शाया जाता है तथा प्रत्येक कोश में इलेक्ट्रॉनों की अधिकतम संख्या 2n होती है।
उपकोश:
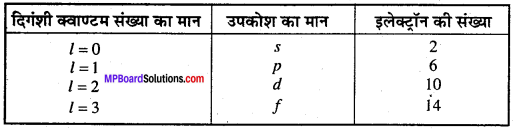
प्रत्येक कोश में कई उप ऊर्जा स्तर या उपकोश होते हैं जिन्हें s, p, d, fद्वारा दर्शाया जाता है। किसी भी कोश में उपकोशों की संख्या 2n2 के बराबर होती है। इन्हें दिगंशी क्वाण्टम संख्या द्वारा निर्धारित किया जाता है। विभिन्न उपकोशों के लिये के मान निश्चित हैं।
कक्षक:
नाभिक के चारों ओर वह त्रिविम क्षेत्र जहाँ इलेक्ट्रॉनों के मिलने की प्रायिकता अधिकतम होती है, कक्षक कहलाते हैं। इनका निर्धारण चुम्बकीय क्वाण्टम संख्याओं की सहायता से किया जाता है।

प्रश्न 24.
स्पष्ट कीजिये, क्यों?
- कैथोड किरणों में उपस्थित कणों पर ऋण आवेश है।
- कैथोड किरणें उनके मार्ग में रखे पहिये को घुमा देती है।
उत्तर:
1. यदि कैथोड किरणों को विद्युत् क्षेत्र से गुजरने दिया जाये तो कैथोड किरणें धनात्मक प्लेटों की ओर विक्षेपित होने लगती हैं जो यह दर्शाती हैं कि कैथोड किरणों में उपस्थित कणों पर ऋण आवेश उपस्थित है।
2. कैथोड किरणों के मार्ग में यदि हल्का पैडल चक्र रख दिया जाये तो वह घूमने लगता है जो यह दर्शाती है कि कैथोड किरणें उच्च गतिज ऊर्जा वाले कणों से मिलकर बनी होती हैं अर्थात् कैथोड किरणे पदार्थ कणों से मिलकर बनी हैं।
प्रश्न 25.
इलेक्ट्रॉन जैसे सूक्ष्म कण की द्वैती प्रकृति से क्या तात्पर्य है?
अथवा
एक गतिशील इलेक्ट्रॉन द्वारा कण एवं तरंग दोनों की समान प्रकृति प्रदर्शित की जाती है। कारण स्पष्ट कीजिये।
उत्तर:
इलेक्ट्रॉन एक सूक्ष्म कण है तथा इलेक्ट्रॉन की कणीय प्रकृति होने के कारण इसका विशिष्ट संवेग होता है तथा गतिशील होने के कारण तरंग के समान व्यवहार प्रदर्शित करता है, जिससे विवर्तन प्रभाव प्राप्त होता है तथा इलेक्ट्रॉन दोनों प्रभाव एक साथ दर्शाता है। अन्य सूक्ष्म कण प्रोटॉन और न्यूट्रॉन यहाँ तक परमाणु भी तीव्र गतिमान किये जाने पर द्वैती प्रकृति दर्शाता है। गतिशील कण द्वारा उत्पन्न तरंग के तरंगदैर्ध्य को डी-ब्रॉग्ली समीकरण द्वारा दर्शाया जाता है। उनके अनुसार किसी भी गतिशील कण का तरंगदैर्घ्य उसके संवेग के व्युत्क्रमानुपाती होता है तथा इसे निम्न समीकरण द्वारा दर्शाया जाता है
λ = \(\frac{h}{mv}\)
या λ = \(\frac{h}{p}\) λ ∝ \(\frac{1}{p}\) [my = p]
जहाँ 2 = अतिसूक्ष्म कण जैसे इलेक्ट्रॉन का तरंगदैर्घ्य, m = कण का द्रव्यमान, v = कण का वेग, p= कण का संवेग, h = प्लांक स्थिरांक। .
प्रश्न 26.
बामर सूत्र क्या है? यह हाइड्रोजन वर्णक्रम की व्याख्या कैसे करता है?
उत्तर:
जे.जे. बामर के अनुसार हाइड्रोजन परमाणु के दृश्य क्षेत्र के स्पेक्ट्रम की रेखाओं की आवृत्ति को निम्नलिखित सूत्र द्वारा दर्शाया जा सकता है –
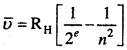
जहाँ RH = रिडबर्ग स्थिरांक है तथा n = 3, 4, 5, 6, ……
यह रेखाओं की श्रेणी दृश्य क्षेत्र में होती है तथा बामर श्रेणी कहलाती है। इसके पश्चात् चार अन्य श्रेणियों का पता चला। पराबैंगनी क्षेत्र में लाइमन श्रेणी तथा अवरक्त क्षेत्र में पाश्चन श्रेणी, ब्रेकेट श्रेणी तथा फुण्ड श्रेणी की रेखायें प्राप्त होती हैं । इनकी व्याख्या करने के लिये बामर सूत्र को निम्न सूत्र के रूप में संशोधित किया गया।

प्रश्न 27.
परमाणु वर्णक्रम को रेखिल वर्णक्रम कहा जाता है, क्यों?
उत्तर:
इस प्रकार का स्पेक्ट्रम समस्त तत्वों के परमाणुओं द्वारा दिया जाता है। इसमें विशिष्ट रंग के अनेक श्रेणीबद्ध पतली चमकीली रेखायें होती हैं जो काली रेखाओं द्वारा पृथक् रहती हैं। प्रत्येक तत्व विशिष्ट प्रकार के रेखिल स्पेक्ट्रम देते हैं तथा ये स्पेक्ट्रम उन तत्वों की विशिष्ट पहचान होती हैं। उदाहरण-सोडियम के स्पेक्ट्रम में 5890 Å और 5896 Å तरंगदैर्घ्य पर दो स्पष्ट पीली रेखाएँ प्राप्त होती हैं।
यदि एक विसर्जन नली में कम दाब पर हाइड्रोजन गैस भरकर उसमें विद्युत् धारा प्रवाहित की जाती है तो एक लाल रंग का प्रकाश दिखाई देगा। इस प्रकार उत्सर्जित प्रकाश का स्पेक्ट्रोस्कोप की सहायता से विश्लेषण किया जाता है तो एक असतत् स्पेक्ट्रम प्राप्त होता है जिसमें चार प्रमुख रेखाएँ प्राप्त होती हैं जिन्हें Hαa, Hβg, Hγ, तथा Hδ कहते हैं । इस प्रकार का स्पेक्ट्रम जिसमें केवल रेखाएँ होती हैं, रेखिल स्पेक्ट्रम कहलाती हैं।
प्रश्न 28.
रदरफोर्ड के प्रकीर्णन प्रयोग के प्रमुख निष्कर्ष लिखिए।
उत्तर:
1. अधिकांश a कण स्वर्णपत्र के आर-पार सीधी रेखाओं में निकल जाते हैं जिससे यह निष्कर्ष निकलता है कि परमाणु का अधिकांश भाग खोखला एवं आवेशहीन होता है।
2. कुछ α कण स्वर्णपत्र से टकराने के पश्चात् विभिन्न कोणों पर विचलित हो जाते हैं क्योंकि α कण धनावेशित हैं। अतः परमाणु के भीतर एक धनावेशित केन्द्र होना चाहिये जिससे धनावेशित α कण प्रतिकर्षित होकर विभिन्न कोणों में विक्षेपित हो जाते हैं। इस भारी धनावेशित केन्द्र को नाभिक कहते हैं।
3. लगभग 20,000 में से एक α कण स्वर्णपत्र से टकराकर अपने पूर्व मार्ग में ही वापिस लौट आता है। क्योंकि परमाणु के आकार की तुलना में नाभिक बहुत छोटा एवं दृढ़ होता है। रदरफोर्ड के अनुसार परमाणु की त्रिज्या 10-8 cm तथा नाभिक की त्रिज्या 10-13 cm होती है।
4. नाभिक के चारों ओर खाली स्थान होता है जिनमें ऋण आवेशित इलेक्ट्रॉन नाभिक के चारों ओर घूमते रहते हैं। इस गति के कारण कार्य करने वाला अपकेन्द्र बल, इलेक्ट्रॉनों तथा धनावेशित नाभिक के मध्य स्थिर वैद्युत आकर्षण बल को संतुलित करता है। इस संतुलन के कारण इलेक्ट्रॉन नाभिक में नहीं गिरते।
परमाणु की संरचना दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
बोर की त्रिज्या की गणना कीजिये।
उत्तर:
हाइड्रोजन परमाणु का एकाकी इलेक्ट्रॉन जब नाभिक के चारों ओर गमन करता है तो उस पर दो बल कार्य करते हैं।
- नाभिक द्वारा लगाया गया आकर्षण बल = \(\frac { Ze^{ 2 } }{ r^{ 2 } } \)
- अपकेन्द्री बल जो बाहर की ओर कार्य करता है = \(\frac { mv^{ 2 } }{ 2 } \)
जहाँ Z = परमाणु संख्या, m = इलेक्ट्रॉन का द्रव्यमान, v = इलेक्ट्रॉन का वेग, e = आवेश, r= परमाणु त्रिज्या।
गतिशील इलेक्ट्रॉन पर कार्यरत् अभिकेन्द्री बल एवं अपकेन्द्री बल बराबर और विपरीत दिशा में कार्य करते हैं तथा दोनों का परिमाण समान हो तो एक-दूसरे को संतुलित करते हैं और इलेक्ट्रॉन अपनी स्थिति पर घूमता रहता है।

प्रश्न 2.
प्रकाश पुंज का प्रिज्म द्वारा अवयवी घटकों में पृथक्करण किस प्रकार होता है? सचित्र वर्णन कीजिए।
उत्तर:
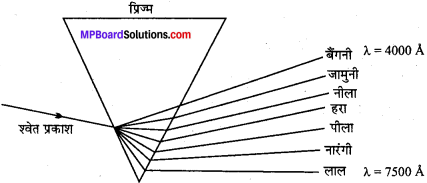
श्वेत प्रकाश को किसी प्रिज्म में से गुजरने दिया जाए तो उसके अवयवी विभिन्न तरंगदैर्घ्य वाली अलग-अलग रंगों वाली किरणों से विक्षेपित हो जाती हैं। यदि प्रिज्म के इस ओर फोटोग्रॉफिक प्लेट लगा दी जाये तो प्रकाश के सात रंग, सात पट्टियों के रूप में आ जाते हैं जिसे सतत् वर्णक्रम कहते हैं। इसमें एक रंग की पट्टी दूसरे रंग की पट्टी में आंशिक रूप से समायी रहती है। इनमें बैंगनी रंग का तरंगदैर्ध्य सबसे कम लेकिन अपवर्तनांक अधिकतम होने के कारण अधिक झुककर अपवर्तित होता है तथा इसकी आवृत्ति सबसे अधिक होती है। लाल रंग का तरंगदैर्ध्य अधिक किन्तु आवृत्ति सबसे कम होती है।
प्रश्न 3.
हाइजेनबर्ग का अनिश्चितता सिद्धान्त समझाइये। इसका गणितीय व्यंजक लिखिए।
उत्तर:
इस सिद्धान्त के अनुसार, “इलेक्ट्रॉन जैसे सूक्ष्म और गतिशील कण की सही स्थिति और संवेग का एक साथ निर्धारण करना असंभव है।”
यदि Δ x = स्थिति में अनिश्चितता, Δ p = संवेग में अनिश्चितता हो, तो
Δx × Δp ≥ \(\frac{h}{4π}\)
⇒ Δx × mΔv ≥ \(\frac{h}{4π}\)
⇒ Δx ∝ \(\frac { 1 }{ \Delta p }\)
Δp यदि इलेक्ट्रॉन जैसे सूक्ष्म कण की स्थिति के निर्धारण की अनिश्चितता Δ x का मान कम हो तो संवेग की अनिश्चितता Δ p का मान अधिक होगा।
मान लो यदि किसी इलेक्ट्रॉन की स्थिति ज्ञात करनी हो तो यह आवश्यक है कि हम उसे देख सकें। इलेक्ट्रॉन को देखने के लिये दृश्य प्रकाश का उपयोग नहीं कर सकते हैं क्योंकि उसका तरंगदैर्घ्य 5000Å इलेक्ट्रॉन के व्यास से बहुत अधिक है। अतः इसके लिये कम तरंगदैर्घ्य वाले विकिरण X-किरण का उपयोग करते हैं। परन्तु X-किरण द्वारा इलेक्ट्रॉन की स्थिति का निर्धारण तब तक नहीं होगा जब वह इलेक्ट्रॉन से न टकराये तथा टकराकर प्रकीर्णित न हो।
X-किरण के फोटॉन के इलेक्ट्रॉन से टकराने से कॉम्पटन प्रभाव उत्पन्न होगा जिससे इलेक्ट्रॉन के वेग में अत्यधिक वृद्धि होगी। इस प्रभाव के कारण इलेक्ट्रॉन का वेग तथा संवेग अनिश्चित हो जायेगा। इलेक्ट्रॉन की सही स्थिति ज्ञात करने के लिये यदि हम और कम तरंगदैर्घ्य के विकिरण का उपयोग करें तो संवेग की अनिश्चितता का मान और बढ़ेगा।
हाइजेनबर्ग के अनिश्चितता सिद्धान्त का निष्कर्ष बोहर सिद्धान्त के निष्कर्ष के विपरीत है। बोर सिद्धान्त के अनुसार किसी कोश में इलेक्ट्रॉन की स्थिति एवं वेग का सही-सही निर्धारण किया जा सकता है। किन्तु हाइजेनबर्ग के अनिश्चितता सिद्धान्त के अनुसार इलेक्ट्रॉन की स्थिति और वेग का सही-सही निर्धारण एक साथ नहीं किया जा सकता है।
प्रश्न 4.
क्वाण्टम संख्या क्या है? क्वाण्टम संख्या कितने प्रकार की होती है ? तथा प्रत्येक से प्राप्त होने वाली जानकारी का वर्णन कीजिए।
उत्तर:
परमाणु में किसी इलेक्ट्रॉन को पूर्ण रूप से अभिव्यक्त करने के लिये जिन संख्याओं की सहायता ली जाती है उन्हें क्वाण्टम संख्या कहते हैं। क्वाण्टम संख्याएँ निम्नलिखित चार प्रकार की होती हैं –
- मुख्य क्वाण्टम संख्या (n)
- दिगंशी क्वाण्टम संख्या (1)
- चुम्बकीय क्वाण्टम संख्या (m)
- चक्रण क्वाण्टम संख्या (s)।
1. मुख्य क्वाण्टम संख्या:
इसे n से दर्शाते हैं। यह इलेक्ट्रॉन के मुख्य कोश को प्रदर्शित करती है। इसकी सहायता से नाभिक से इलेक्ट्रॉन की औसत दूरी, इलेक्ट्रॉन की ऊर्जा, इलेक्ट्रॉन अभ्र के प्रभावी आयतन का निर्धारण किया जा सकता है।n का मान शून्य के अतिरिक्त कोई भी पूर्ण संख्या होती है।
2. दिगंशी क्वाण्टम संख्या:
इसे ! से दर्शाते हैं। यह उपकोशों को प्रदर्शित करता है। इससे इलेक्ट्रॉन का कोणीय संवेग, उपकोशों की आकृति, किसी कोश में उपस्थित उपकोशों की संख्या का निर्धारण करते हैं। के मान मुख्य क्वाण्टम संख्या पर निर्भर करते हैं। किसी n के लिये l के मान 0 से लेकर n – 1 तक होते हैं। l के अधिक-से-अधिक चार मान 0, 1, 2 अथवा 3 होते हैं जो क्रमशः s, p, d एवं f उपकोशों को प्रकट करते हैं।
यदि n = 1 l = 0 अर्थात् s उपकोश
n = 2 l = 0, 1 अर्थात् s व p उपकोश
n = 3 l = 0, 1, 2 अर्थात् s, p, d उपकोश
n = 4 l = 0, 1, 2, 3 अर्थात् s, p, d वf उपकोश
3. चुम्बकीय क्वाण्टम संख्या:
इसे m से दर्शाते हैं। यह परमाणु स्पेक्ट्रम के स्रोत को चुम्बकीय क्षेत्र में रखने पर प्राप्त स्पेक्ट्रमी रेखाओं के विघटन अथवा जीमन प्रभाव को दर्शाता है। यह किसी उपकोश में उपस्थित कक्षकों की संख्या को दर्शाता है। किसी l के लिये m के मान -l से +l तक होते हैं। यदि l = 0, m = 0, l = 1 तो m = -1, 0 + 1 तथा l = 2, m = -2, -1, 0, +1, +2 और l = 3 तो m = -3, -2, -1, 0, +1, +2, +3 होता है, इस प्रकार m के संपूर्ण मानों की संख्या 2l + 1 होती है।
4. चक्रण क्वाण्टम संख्या:
इसे 5 से दर्शाते हैं । कोणीय संवेग या स्पिन ऊर्जा को व्यक्त करने के लिये चक्रण क्वाण्टम संख्या s का प्रयोग किया जाता है। s के 2 मान होते हैं। दक्षिणावर्त तथा वामावर्त घूर्णन के अनुसार चक्रण क्वाण्टम संख्या के दो मान +\(\frac{1}{2}\) तथा –\(\frac{1}{2}\) होते हैं।
प्रश्न 5.
बोर का परमाणु सिद्धान्त हाइड्रोजन परमाणु के रेखिल वर्णक्रम की व्याख्या करने के किस प्रकार सहायक सिद्ध हुआ? समझाइए।
अथवा
हाइड्रोजन वर्णक्रम की विभिन्न वर्णक्रम रेखाओं से बोर मॉडल का वर्णन कीजिए।
उत्तर:
हाइड्रोजन परमाणु के रेखिल स्पेक्ट्रम में अनेक रेखाओं की पाँच श्रेणियाँ प्राप्त होती हैं। ये श्रेणियाँ अलग-अलग तरंगदैर्घ्य के क्षेत्र में होती हैं। जैसे-लाइमन श्रेणी पराबैंगनी क्षेत्र में, बामर श्रेणी दृश्य क्षेत्र में पाश्चन, ब्रेकेट एवं फुण्ड श्रेणियाँ अवरक्त क्षेत्र में होती हैं।
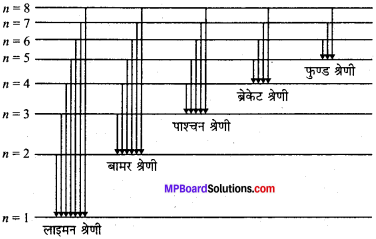
हाइड्रोजन परमाणु में केवल एक इलेक्ट्रॉन होता है, लेकिन इसके स्पेक्ट्रम में अनेक रेखाएँ प्राप्त होती हैं, बोर ने इसका स्पष्टीकरण किया। उनके अनुसार प्रत्येक परमाणु में कुछ निश्चित ऊर्जा स्तर होते हैं जिनमें अनुरूप ऊर्जा वाले इलेक्ट्रॉन चक्कर लगाते रहते हैं। हाइड्रोजन गैस में असंख्य हाइड्रोजन परमाणु होते. हैं जिनकी सामान्य अवस्था में इलेक्ट्रॉन निम्नतर प्रथम ऊर्जा स्तर में रहता है। जब हाइड्रोजन परमाणु को बाहर से उपयुक्त ऊर्जा मिलती है तो विभिन्न परमाणु ऊर्जा का अवशोषण करके विभिन्न ऊर्जा स्तरों में चले जाते हैं।
ये इलेक्ट्रॉन उच्चतम ऊर्जा स्तर में 10-8 सेकण्ड रहकर तुरन्त ही ऊर्जा का उत्सर्जन करके किसी भी निम्नतम ऊर्जा स्तर में आ जाता है। इस प्रक्रिया को संक्रमण कहते हैं। इस ऊर्जा का उत्सर्जन प्रकाश के फोटॉन के रूप में होता है। प्रत्येक फोटॉन की आवृत्ति तथा तरंगदैर्घ्य निश्चित होती है जिसके फलस्वरूप ही वर्णक्रम में विभिन्न रेखाएँ प्राप्त होती हैं। परमाणु की विभिन्न ऊर्जा स्तरों में सबसे अंदर की ऊर्जा स्तर n = 1 में इलेक्ट्रॉनों के वापिस आने से लाइमन श्रेणी प्राप्त होती है। इसी प्रकार जब ऊर्जा स्तर 3, 4, 5 से इलेक्ट्रॉन दूसरी कक्षा में आता है तो बामर श्रेणी प्राप्त होती है। इसी प्रकार जब इलेक्ट्रॉन विभिन्न उच्च ऊर्जा स्तरों में क्रमशः तीसरे, चौथे और पाँचवें कोश में आता है तो पाश्चन, ब्रेकेट तथा फुण्ड श्रेणी प्राप्त होती है।
माना एक इलेक्ट्रॉन उच्च ऊर्जा स्तर n1 से जिसमें उसकी ऊर्जा E1 है से निम्न ऊर्जा स्तर n2 जिसमें उसकी ऊर्जा E2 में आता है तथा प्राप्त रेखा की आवृत्ति ν हो तो।

जहाँ RH रिडबर्ग स्थिरांक है। उपर्युक्त समीकरण की सहायता से बामर ने R के प्रायोगिक मान की गणना की। R के मान की गणना करने पर R का मान 109677.8 cm-1 प्राप्त होता है। स्पष्ट है कि n = 1, 2, 3, 4, 5 तथा n2 के विभिन्न मान रखने पर क्रमशः लाइमन, बामर, पाश्चन, ब्रेकेट तथा फुण्ड श्रेणियाँ प्राप्त होती हैं।
प्रश्न 6.
कक्षक s, p तथा d आकृति कैसी होती है?
उत्तर:
कक्षक का आकार:
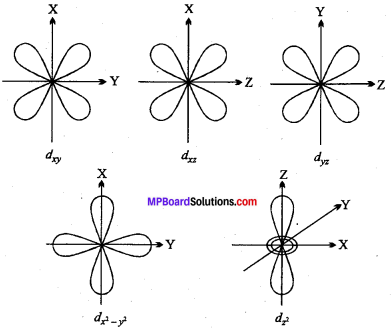
द्विगंशी क्वाण्टम संख्या किसी ऑर्बिटल का आकार निर्धारित करती है। यदि l = 0 हो तो कक्षक कोणीय संवेग का मान शून्य होता है। अतः s आर्बिटल अदैशिक तथा गोलतः सममित होता है अर्थात् नाभिक से किसी निश्चित दूरी पर इलेक्ट्रॉन के पाये जाने की संभावना सभी दिशाओं में समान होती है। मुख्य क्वाण्टम संख्या में वृद्धि के साथ-साथ s कक्षक का आकार भी बढ़ता जाता है। यदि मुख्य क्वाण्टम संख्या का मान n है तो s कक्षक में n समकेन्द्रिक गोले होंगे तथा n के मान में वृद्धि के साथ s कक्षक की ऊर्जा में भी वृद्धि होती है तथा मुख्य क्वाण्टम संख्या का मान n होने पर नोडल तलों की संख्या n – 1 होती है।
p कक्षक का आकार:
यदि n = 2 हो तो l = 0, 1 होता है। l = 1 के लिये m के तीन मान -1, 0, +1 होते हैं। इसका अर्थ यह है कि p उपकोश में तीन कक्षक होते हैं जिन्हें P., P, तथा p. से दर्शाते हैं। इन तीनों p कक्षकों की ऊर्जाएँ समान होती हैं। परन्तु उनके दिक्विन्यास भिन्न होते हैं। Px, Py, Pz, कक्षक क्रमशः x, y तथा : अक्ष की दिशाओं में सममित होते हैं। p कक्षक का आकार डम्बल होता है। प्रत्येक कक्षक की दोनों पालियाँ एक तल द्वारा पृथक् होती हैं जहाँ इलेक्ट्रॉन घनत्व शून्य होता है, यह तल नोडल तल कहलाता है।
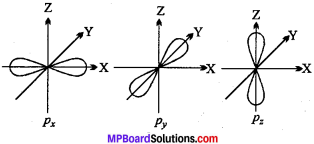
d कक्षक का आकार:
d कक्षक के लिये l = 2 होता है अतः चुम्बकीय क्वाण्टम संख्या m के पाँच विभिन्न मान -2, -1, 0, +1, +2 होते हैं। इन्हें क्रमश: dxy, dyz, dxzx dx2–y2, dzx से दर्शाते हैं। इनके आकार अलग-अलग किन्तु ऊर्जा समान होती है। तीन कक्षक dy,dy,du के आकार समान होते हैं, परन्तु इनकी चारों पालियाँ जो उच्च इलेक्ट्रॉन घनत्व दर्शाती हैं xy, yz तथा zx के तल पर स्थित होती हैं। ये दोहरे डम्बल आकृति के होते हैं। dx2–y2 कक्षक dxy कक्षक के समान होता है लेकिन पालियाँ x – अक्ष और Y – अक्ष पर स्थित होती हैं। dz2 कक्षक की दोनों पालियाँ अक्ष Z – अक्ष पर स्थित होती हैं। इसमें उच्च इलेक्ट्रॉन घनत्व दर्शाने वाली रिंग होती है जो xy – तल पर स्थित रहती है।