MP Board Class 9th Science Solutions Chapter 3 परमाणु एवं अणु
MP Board Class 9th Science Chapter 3 पाठ के अन्तर्गत के प्रश्नोत्तर
प्रश्न शृंखला – 1 # पृष्ठ संख्या 36
प्रश्न 1.
एक अभिक्रिया में 5.3g सोडियम कार्बोनेट एवं 6.0g एथेनॉइक अम्ल अभिकृत होते हैं। 2 : 2g कार्बन डाइऑक्साइड, 8 : 2g सोडियम एथेनॉएट एवं 0.9g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
(सोडियम कार्बोनेट) + (एथेनॉइक अम्ल) → (सोडियम एथेनॉएट) + (कार्बन डाइऑक्साइड) + (जल)
हल:
अभिकारक (क्रियाकारकों) का कुल द्रव्यमान = 5.3 g + 6.0 g = 11.3 g
उत्पादों का कुल द्रव्यमान = 2.2 g + 8.2 g + 0.9 g = 11.3 g
चूँकि गणना के फलस्वरूप प्राप्त अभिकारकों का द्रव्यमान = उत्पादों का द्रव्यमान
अतः यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
प्रश्न 2.
हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 1 : 8 के अनुपात में संयोग करके जल निर्मित करते हैं। 3 g हाइड्रोजन गैस के साथ पूर्णरूप से संयोग करने के लिए कितनी ऑक्सीजन गैस
के द्रव्यमान की आवश्यकता होगी ?
हल:
माना आवश्यक ऑक्सीजन गैस का द्रव्यमान = x g है।
3 : x = 1 : 8 ⇒ x = \(\frac { 3\times8 }{ 1 }\) = \(\frac { 24 }{ 1 }\) = 24g
अतः ऑक्सीजन गैस का अभीष्ट द्रव्यमान = 24g
प्रश्न 3.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर:
“परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो किसी रासायनिक क्रिया में न तो सृजित होते हैं और न ही उनका विनाश होता है।”
प्रश्न 4.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है ?
उत्तर:
“किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।”
![]()
प्रश्न श्रृंखला – 2 # पृष्ठ संख्या 40
प्रश्न 1.
परमाणु द्रव्यमान इकाई को परिभाषित कीजिए। (2019)
उत्तर:
परमाणु द्रव्यमान इकाई-“कार्बन-12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12 वें भाग को मानक परमाणु द्रव्यमान इकाई कहते हैं।”
प्रश्न 2.
एक परमाणु को आँखों द्वारा देखना क्यों सम्भव नहीं होता है ?
उत्तर:
एक परमाणु का आकार अत्यन्त सूक्ष्म नैनोमीटर में मापने योग्य होता है जिससे हमारी आँखें उसे देख नहीं सकती।
प्रश्न श्रृंखला – 3 # पृष्ठ संख्या 44
प्रश्न 1.
निम्न के सूत्र लिखिए
(i) सोडियम ऑक्साइड (2019)
(ii) ऐलुमिनियम क्लोराइड, (2018, 19)
(iii) सोडियम सल्फाइड,
(iv) मैग्नीशियम हाइड्रॉक्साइड। (2018, 19)
उत्तर:
(i) Na2O,
(ii) AlCl3,
(iii) Na2S,
(iv) Mg(OH)2.
प्रश्न 2.
निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए-
(i) Al2(SO4)3,
(ii) CaCl2 (2018),
(iii) K2SO4,
(iv) KNO3 (2018),
(v) CaCO3.
उत्तर:
(i) ऐलुमिनियम सल्फेट,
(ii) कैल्सियम क्लोराइड,
(iii) पोटैशियम सल्फेट,
(iv) पोटैशियम नाइट्रेट,
(v) कैल्सियम कार्बोनेट।
प्रश्न 3.
रासायनिक सूत्र का क्या तात्पर्य है ?
उत्तर:
रासायनिक सूत्र-“किसी अणु को उसके अवयवी तत्वों के संकेतों द्वारा व्यक्त करने को रासायनिक सूत्र कहते हैं।” यह उस यौगिक का संघटक प्रतीकात्मक निरूपण होता है।
प्रश्न 4.
निम्नलिखित में कितने परमाणु विद्यमान हैं ?
(i) H2S अणु एवं
(ii) PO43- आयन।
उत्तर:
(i) तीन,
(ii) पाँच।
![]()
प्रश्न श्रृंखला – 4 # पृष्ठ संख्या 46
प्रश्न 1.
निम्न यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिए-
H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH.
हल:
H2 का आण्विक द्रव्यमान = 2 x 1 = 2
O2 का आण्विक द्रव्यमान = 2 x 16 = 32
Cl2 का आण्विक द्रव्यमान = 2 x 35.5 = 71
CO2 का आण्विक द्रव्यमान = 12 + 2 x 16 = 12 + 32 = 44
CO2 का आण्विक द्रव्यमान = 12 + 4 x 1 = 12 + 4 = 16
C2H6 का आण्विक द्रव्यमान = 2 x 12 + 6 x 1 = 24 + 6 = 30
C2H4 का आण्विक द्रव्यमान = 2 x 12 + 4 x 1 = 24 + 4 = 28
NH3 का आण्विक द्रव्यमान = 14 + 3 x 1 = 14 +3 = 17
CH3OH का आण्विक द्रव्यमान = 12 + 3 x 1 + 16 + 1
= 12 + 3 + 16 + 1 = 32
प्रश्न 2.
निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए-
ZnO, Na2O एवं K2CO3
दिया गया है: Zn का परमाणु द्रव्यमान = 65 u
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39 u
C का परमाणु द्रव्यमान = 12 u एवं
O का परमाणु द्रव्यमान = 16 u है।
हल:
ZnO का सूत्र इकाई द्रव्यमान = 65 u + 16 u = 81 u
Na2O का सूत्र इकाई द्रव्यमान = 2 x 23 u + 16u
= 46 u + 16 u = 62 u
K2CO3 का सूत्र इकाई द्रव्यमान = 2 x 23 u + 12 u + 3 x 16 u
= 46u + 12 u + 48 u= 106 u
प्रश्न श्रृंखला – 5 # पृष्ठ संख्या 48
प्रश्न 1.
यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 g है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा?
हल:

अतः कार्बन के एक परमाणु का अभीष्ट द्रव्यमान = 1.99 x 1023 g (लगभग)
प्रश्न 2.
किसमें अधिक परमाणु होंगे : 100g सोडियम (Na) अथवा 100 g लोहा (Fe)? Na का परमाणु द्रव्यमान = 23 u, Fe का परमाणु द्रव्यमान = 56 u.
हल:

उपर्युक्त परिणामों से स्पष्ट है कि सोडियम (Na) में परमाणुओं की संख्या अधिक होगी।
MP Board Class 9th Science Chapter 3 पाठान्त अभ्यास के प्रश्नोत्तर
प्रश्न 1.
0.24g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096 g बोरॉन एवं 0.144 g ऑक्सीजन है। इस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
हल:

अतः यौगिक का अभीष्ट प्रतिशत संघटन, बोरॉन = 40%
एवं ऑक्सीजन 360%
प्रश्न 2.
3.0g कार्बन 8:00g ऑक्सीजन में जलकर 11.0g कार्बन डाइ-ऑक्साइड निर्मित करता है। जब 3.00g कार्बन को 50.0g ऑक्सीजन में जलाएंगे तो कितने ग्राम कार्बन डाइ-ऑक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित है ?
उत्तर:
11.0g कार्बन डाइ ऑक्साइड का निर्माण होगा।
यह रासायनिक संयोजन के स्थिर अनुपात के नियम पर आधारित है।
प्रश्न 3.
बहुपरमाणुक आयन क्या होते हैं ? उदाहरण दीजिए।
उत्तर:
बहुपरमाणुक आयन-“परमाणुओं का वह समूह जिस पर नेट आवेश विद्यमान हो उसे बहुपरमाणुक आयन कहते हैं।
उदाहरण:
NH4+, SO4— आदि।
प्रश्न 4.
निम्नलिखित के रासायनिक सूत्र लिखिए-
(a) मैग्नीशियम क्लोराइड
(b) कैल्सियम क्लोराइड
(c) कॉपर नाइट्रेट
(d) ऐलुमिनियम क्लोराइड
(e) कैल्सियम कार्बोनेट।
उत्तर:
(a) MgCl2,
(b) CaCl2,
(c) Cu(NO3)2,
(d) AlCl3;
(e) CaCO3.
प्रश्न 5.
निम्नलिखित यौगिकों में विद्यमान तत्वों के नाम लिखिए
(a) बुझा हुआ चूना, (2019)
(b) हाइड्रोजन ब्रोमाइड, (2019)
(c) बेकिंग पाउडर (खाने वाला सोडा), (2019)
(d) पोटैशियम सल्फेट
उत्तर:
(a) कैल्सियम, ऑक्सीजन, हाइड्रोजन,
(b) हाइड्रोजन, ब्रोमीन,
(c) सोडियम, हाइड्रोजन, कार्बन, ऑक्सीजन,
(d) पोटैशियम, सल्फर, ऑक्सीजन।
प्रश्न 6.
निम्नलिखित पदार्थों के मोलर द्रव्यमान का परिकलन कीजिए
(a) इथाइन C2H2,
(b) सल्फर अणु Sg,
(c) फॉस्फोरस अणु P4 (फॉस्फोरस का परमाणु द्रव्यमान = 31),
(d) हाइड्रोक्लोरिक अम्ल HCl,
(e) नाइट्रिक अम्ल।
उत्तर:
(a) इथाइन C2H2 का मोलर द्रव्यमान = 2 x 12 + 2 x 1 = 24 + 2 = 26g
(b) सल्फर अणु Sg का मोलर द्रव्यमान = 8 x 32 = 256g
(c) फॉस्फोरस अणु P का मोलर द्रव्यमान = 4 x 31 = 124g
(d) हाइड्रोक्लोरिक अम्ल HCl का मोलर द्रव्यमान = 1 + 35.5 = 36.5
(e) नाइट्रिक अम्ल HNO3 का मोलर द्रव्यमान = 1 + 14 + 3 x 16
= 1 + 14 + 48 = 63 g
अतः अभीष्ट मोलर द्रव्यमान = (a) 26g, (b) 256 g, (c) 124g, (d) 36.5g, (e) 63 g.
प्रश्न 7.
निम्न का द्रव्यमान क्या होगा-
(a) 1 मोल नाइट्रोजन परमाणु ?
(b) 4 मोल ऐलुमिनियम परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27) ?
(c) 10 मोल सोडियम सल्फाइट (Na2SO3)?
उत्तर:
(a) 14 g,
(b) 4 x 27 = 108 g
(c) 10 x (2 x 23 + 32+3 x 16) = 10 (46+ 32+ 48)
= 10 x 126 = 1260g
अतः अभीष्ट द्रव्यमान = (a) 14 g, (b) 108 g, (c) 1260 g.
![]()
प्रश्न 8.
मोल में परिवर्तित कीजिए-
(a) 12 g ऑक्सीजन गैस
(b) 20 g जल
(c)22 g कार्बन डाइ-ऑक्साइड।
हल:


अतः अभीष्ट मोल संख्या = (a) 0.375 मोल, (b) 1.11 मोल, (c) 0.5 मोल
प्रश्न 9.
निम्न का द्रव्यमान क्या होगा-
(a) 0.2 मोल ऑक्सीजन परमाणु ?
(b) 0.5 मोल जल अणु ?
हल:
(a) ऑक्सीजन का द्रव्यमान = ऑक्सीजन परमाणु का मोलर द्रव्यमान x मोल संख्या = 16 x 0.2 = 3.2g
(b) जल का द्रव्यमान = जल का मोलर द्रव्यमान x जल की मोल संख्या
= 18 x 0.5 = 9.0g
अत: अभीष्ट द्रव्यमान = (a) 3.2 g, (b) 9.0g
प्रश्न 10.
16 g ठोस सल्फर में सल्फर (S8) के अणुओं की संख्या का परिकलन कीजिए।
हल:
सल्फर (S8) का मोलर द्रव्यमान = 8 x 32 = 256 g

अत: अभीष्ट अणुओं की संख्या = 3.76 x 1022 अणु
प्रश्न 11.
0.051 g ऐलुमिनियम ऑक्साइड (Al2O3) में ऐलुमिनियम आयन की संख्या का परिकलन कीजिए। (ऐलुमिनियम का परमाणु द्रव्यमान = 27u है।)
हल:
Al2O3 का मोलर द्रव्यमान = 2 x 27 + 3 x 16 = 54 + 48 = 102 g

Al2O3 के एक अणु में Al+++ आयन की संख्या 2 है। इसलिए
Al+++ की कुल संख्या = 2 x 3:011 x 1020 = 6.022 x 1020 आयन
अतः ऐलुमिनियम के आयनों की अभीष्ट संख्या = 6.022 x 1020 आयन
MP Board Class 9th Science Chapter 3 परीक्षोपयोगी अतिरिक्त प्रश्नोत्तर
MP Board Class 9th Science Chapter 3 वस्तुनिष्ठ प्रश्न
बहु-विकल्पीय प्रश्न
प्रश्न 1.
निम्नलिखित में से कौन-सा 360g जल को सही रूप में निरूपित करता है?
(i) 2 मोल जल
(ii) 20 मोल जल
(iii) जल के 6.022 x 1023अणु
(iv) जल के 1.2044 x 1025 अणु।
(a) (i) तथा (ii)
(b) (i) तथा (iv)
(c) (ii) तथा (iii)
(d) (ii) तथा (iv).
उत्तर:
(d) (ii) तथा (iv)
प्रश्न 2.
एक परमाणु के लिए निम्नलिखित में कौन-सा कथन सत्य नहीं है ?
(a) परमाणु स्वतन्त्र अस्तित्व में नहीं रह पाते
(b) परमाणु मूल इकाइयाँ हैं जिनसे अणुओं और आयनों का निर्माण होता है
(c) परमाणु सदैव उदासीन प्रकृति के होते हैं
(d) परमाणु बड़ी संख्या में परस्पर जुड़कर पदार्थ का निर्माण करते हैं, जिसे हम देख, अनुभव या स्पर्श कर सकते हैं।
उत्तर:
(a) परमाणु स्वतन्त्र अस्तित्व में नहीं रह पाते
प्रश्न 3.
नाइट्रोजन गैस का रासायनिक प्रतीक है-
(a) Ni
(b) N2
(c) N+
(d) N.
उत्तर:
(d) N.
प्रश्न 4.
सोडियम का रासायनिक प्रतीक है- (2019)
(a) SO
(b) Sd
(c) NA
(d) Na.
उत्तर:
(d) Na.
प्रश्न 5.
निम्नलिखित में किसका भार सबसे अधिक होगा ?
(a) सुक्रोज (C12 H22O11 ) के 0.2 मोल
(b) CO2 के 2 मोल
(c) CaCO3 के 2 मोल
(d) H2 O के 10 मोल।
उत्तर:
(c) CaCO3 के 2 मोल
प्रश्न 6.
निम्न में से किसमें परमाणुओं की संख्या अधिकतम होगी ? (2019)
(a) H2 O के 18g
(b) O2 के 18g
(c) CO2 के 18 g
(d) CH4 के 18g.
उत्तर:
(d) CH4 के 18g.
प्रश्न 7.
निम्नलिखित में से किसमें अणुओं की संख्या अधिकतम होगी ?
(a) 1 g CO2
(b) 1 g N2
(c) 1 g H2
(d) 1 g CH4.
उत्तर:
(c) 1 g H2
प्रश्न 8.
ऑक्सीजन के एक परमाणु का द्रव्यमान होता है

उत्तर:
(a)
प्रश्न 9.
एक बीकर में 3.42 g सुक्रोज को 18 g जल में विलेय किया जाता है। विलयन में उपस्थित ऑक्सीजन परमाणुओं की संख्या है-
(a) 6.68 x 1023
(b) 6.09 x 1022
(c) 6.022 x 1023
(d) 6.022 x 1021.
उत्तर:
(a) 6.68 x 1023
प्रश्न 10.
भौतिक अवस्था में परिवर्तन लाया जा सकता है-
(a) केवल जब तन्त्र को ऊर्जा दी जाती है
(b) केवल जब तन्त्र से ऊर्जा ली जाती है
(c) केवल जब तन्त्र को ऊर्जा दी जाती है या ली जाती है
(d) बिना किसी ऊर्जा परिवर्तन के।
उत्तर:
(c) केवल जब तन्त्र को ऊर्जा दी जाती है या ली जाती है
प्रश्न 11.
आवोगाद्रो स्थिरांक है- (2018)
(a) 6.022 x 1023
(b) 6.002 x 1023
(c)6.022 x 1022
(d) 6.022 x 1020
उत्तर:
(a) 6.022 x 1023
![]()
रिक्त स्थानों की पूर्ति
1. एक रासायनिक अभिक्रिया में अभिकारकों और उत्पादों के द्रव्यमानों का योग अपरिवर्तित रहता है। यह …………… कहलाता है।
2. निश्चित आवेश युक्त परमाणुओं का समूह …………….. कहलाता है।
3. Ca3 (PO4 )2 का सूत्र इकाई द्रव्यमान …………….. है।
4. सोडियम कार्बोनेट का सूत्र ………… है और अमोनियम सल्फेट का सूत्र ……….. है।
उत्तर:
- द्रव्यमान संरक्षण का नियम,
- बहुपरमाणुक आयन,
- [(3 x Ca का परमाणु द्रव्यमान) + (2 x P का परमाणु द्रव्यमान) + (8 x O परमाणु का द्रव्यमान)],
- Na2 CO3 , (NH4 )2 SO4 .
सही जोड़ी बनाना
स्तम्भ ‘A’ स्तम्भ ‘B’
1. परमाणु (i) लवाइजिए एवं प्राउस्ट
2. अणु (ii) SO4—, CH–
3., परमाणु सिद्धान्त (iii) तत्व
4. रासायनिक संयोजन के नियम (iv) यौगिक
5. आयन (2018) (v) जॉन डाल्टन
6. सोडियम (2018) (vi) C
7. कार्बन (2018) (vii) Na
उत्तर:
- → (iii)
- → (iv)
- → (v)
- → (i)
- → (ii)
- → (vii)
- → (vi).
सत्य/असत्य कथन
1. परमाणु सदैव स्वतन्त्र अवस्था में रहता है।
2. परमाणु किसी तत्व का सूक्ष्मतम कण होता है।
3. अणु कभी भी स्वतन्त्र अवस्था में नहीं रहता है।
4. अणु किसी यौगिक का सूक्ष्मतम कण होता है।
5. परमाणुओं का अनावेशित समुच्चय आयन होता है।
उत्तर:
- असत्य
- सत्य
- असत्य
- सत्य
- असत्य।
एक शब्द/वाक्य में उत्तर
प्रश्न 1.
ऐलुमिनियम सल्फेट का अणुसूत्र लिखिए।
उत्तर:
Al2(SO4)3.
प्रश्न 2.
अक्रियशील गैसों की परमाणुकता बताइए।
उत्तर:
एक।
प्रश्न 3.
एक मोल में कितने कण होते हैं?
उत्तर:
6.022 x 1023
प्रश्न 4.
किस वैज्ञानिक ने सर्वप्रथम मोल शब्द का प्रयोग किया?
उत्तर:
ओस्टवाल्ड।
प्रश्न 5.
पोटैशियम परमाणु का संकेत लिखिए।
उत्तर:
K
प्रश्न 6.
सोडियम क्लोराइड का अणुसूत्र लिखिए। (2019)
उत्तर:
NaCl.
प्रश्न 7.
कैल्सियम हाइड्रॉक्साइड का रासायनिक सूत्र लिखिए। (2019)
उत्तर:
Ca(OH)2.
MP Board Class 9th Science Chapter 3 अति लघु उत्तरीय प्रश्न
प्रश्न 1.
द्रव्यमान संरक्षण का नियम लिखिए। (2019)
उत्तर:
द्रव्यमान संरक्षण का नियम-“किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है और न ही विनाश।”
प्रश्न 2.
स्थिर अनुपात के नियम से क्या समझते हो ? (2019)
उत्तर:
स्थिर अनुपात का नियम-“किसी भी यौगिक में तत्व सदैव ही एक निश्चित द्रव्यमानों के अनुपात में विद्यमान होते हैं चाहे वह यौगिक किसी भी स्रोत से लिया गया हो अथवा किसी भी प्रकार से निर्मित किया गया हो।”
प्रश्न 3.
परमाणु से क्या समझते हो.?
उत्तर:
परमाणु-“किसी तत्व का वह सूक्ष्मतम कण जिसमें तत्व के सभी गुण विद्यमान होते हैं तथा जो तत्व की रचनात्मक इकाई होती है, परमाणु कहलाता है।”
प्रश्न 4.
परमाणु द्रव्यमान (परमाणु भार) से क्या समझते हो ? (2019)
उत्तर:
परमाणु द्रव्यमान (परमाणु भार)-“किसी तत्व का एक परमाणु, कार्बन-12 के एक परमाणु के \(\frac { 1 }{ 12 }\) भाग से जितना गुना भारी होता है, वह संख्या उस तत्व का परमाणु द्रव्यमान (परमाणु भार) कहलाती है।”
प्रश्न 5.
अणु किसे कहते हैं ?
उत्तर:
अणु-“किसी तत्व या यौगिक का वह सूक्ष्मतम कण जो स्वतन्त्र रूप से अस्तित्व में रह सकता है तथा जिसमें उस तत्व एवं यौगिक के सम्पूर्ण गुण विद्यमान होते हैं, अणु कहलाता है।”
प्रश्न 6.
आयन किसे कहते हैं ?
उत्तर:
आयन-“किसी भी आवेशित कण को आयन कहते हैं।”
प्रश्न 7.
रासायनिक सूत्र किसे कहते हैं ?
उत्तर:
रासायनिक सूत्र-“किसी यौगिक के संघटन का प्रतीकात्मक निरूपण रासायनिक सूत्र कहलाता है।”
प्रश्न 8.
आण्विक द्रव्यमान (अणु भार) से क्या समझते हो ? (2019)
उत्तर:
आण्विक द्रव्यमान (अणु भार)-“किसी पदार्थ के अणु में विद्यमान सभी संघटक परमाणुओं के द्रव्यमानों का योग उस पदार्थ का आण्विक द्रव्यमान (अणु भार) कहलाता है।
प्रश्न 9.
एक मोल से क्या समझते हो ?
उत्तर:
मोल-किसी पदार्थ (तत्व, यौगिक या आयन) के 6.022 x 1023 कणों (परमाणु, अणु अथवा आयनों) को एक मोल कहते हैं।”
![]()
प्रश्न 10.
निम्नलिखित में से कौन-सा सही रासायनिक सूत्र प्रदर्शित करता है ? इसका नाम दीजिए-
(a) Al(SO4)3,
(b) BiPO4,
(c)AlCl2.
उत्तर:
(b) BiPO4 बिस्मथ फॉस्फेट।
प्रश्न 11.
क्या ताप के साथ पदार्थ की विलेयता परिवर्तित होती है ? एक उदाहरण दीजिए।
उत्तर:
हाँ। ताप वृद्धि के साथ प्रायः विलेयता बढ़ती है। उदाहरण-गर्म जल में ठंडे जल की अपेक्षा अधिक शक्कर घुलती है।
प्रश्न 12.
आपको सफेद रंग का एक महीन चूर्ण दिया गया है जो शक्कर या नमक हो सकता है। बिना चखे आप इसकी पहचान कैसे करेंगे ?
उत्तर:
(1) दिए गए चूर्ण का कुछ भाग गर्म करते हैं। अगर चूर्ण काला पड़ जाता है तो चूर्ण शक्कर है, नहीं तो नमक।
(2) चूर्ण के शेष भाग का जलीय विलयन बनाकर विद्युत चालकता ज्ञात करेंगे। अगर विलयन चालक है तो नमक है अन्यथा शक्कर।
प्रश्न 13.
12 g द्रव्यमान वाले मैग्नीशियम रिबन में मैग्नीशियम के मोलों की संख्या परिकलित कीजिए। मैग्नीशियम का मोलर परमाणु द्रव्यमान 24g प्रति मोल है।
हल:

अतः मैग्नीशियम के अभीष्ट मोलों की संख्या = 0.5 मोल
प्रश्न 14.
अणु और परमाणु में अन्तर लिखिए। (कोई दो)
उत्तर:
अणु और परमाणु में अन्तर

MP Board Class 9th Science Chapter 3 लघु उत्तरीय प्रश्न
प्रश्न 1.
निम्नलिखित यौगिकों के आण्विक सूत्र लिखिए-
(a) कॉपर (II) ब्रोमाइड,
(b) ऐलुमिनियम (III) नाइट्रेट,
(c) कैल्सियम (II) फॉस्फेट,
(d) आयरन (III) सल्फाइड,
(e) मरकरी (II) क्लोराइड,
(f) मैग्नीशियम (II) ऐसीटेट।
उत्तर:
(a) CuBr2,
(b) Al(NO3)3,
(c)Ca3(PO)2,
(d) Fe2S3,
(e) HgCl2,
(f) (CH3COO)2Mg.
![]()
प्रश्न 2.
निम्नलिखित आयनों के संयोग से बनने वाले सभी यौगिकों के आण्विक सूत्र लिखिए-
Cu2+, Na+, Fe3+, Cl–, SO42-, PO43-.
उत्तर:
CuCl2, CuSO4, Cu3(PO4)2, NaCl, Na2SO4, Na3PO4, FeCl3, Fe2(SO4)3, FePO4.
प्रश्न 3.
निम्नलिखित यौगिकों में उपस्थित (यदि कोई हो तो) धनायनों और ऋणायनों को लिखिए
(a) CH3COONa,
(b) NaCl,
(c) H2,
(d) NH4NO3.
उत्तर:
(a) CH3COO– , Na+,
(b) Na+, Cl–,
(d) NH4+, NO4–.
प्रश्न 4.
तत्वों के निम्नलिखित समुच्चयों से बनने वाले यौगिकों के सूत्र दीजिए-
(a) कैल्सियम और फ्लुओरीन,
(b) हाइड्रोजन और सल्फर,
(c) नाइट्रोजन और हाइड्रोजन,
(d) कार्बन और क्लोरीन,
(e) सोडियम और ऑक्सीजन,
(f) कार्बन और ऑक्सीजन। –
उत्तर:
(a) CaF2,
(b) H2S,
(c) NH3,
(d) CCl4,
(e) Na2O,
(1) CO अथवा CO2.
प्रश्न 5.
तत्वों के निम्नलिखित प्रतीकों में से कौन से गलत हैं ? उनके सही प्रतीक दीजिए-
(a) कोबाल्ट CO,
(b) कार्बन C,
(c) ऐलुमिनियम AL,
(d) हीलियम He,
(e) सोडियम SO.
उत्तर:
(a) कोबाल्ट CO, (c) ऐलुमिनियम AL एवं (e) सोडियम SO प्रतीक गलत है। इनका सही रूप निम्नवत् है-
(a) कोबाल्ट Co, (c) ऐलुमिनियम Al (e) सोडियम Na.
प्रश्न 6.
निम्नलिखित में से प्रत्येक रासायनिक स्पीशीज के लिए उनमें उपस्थित परमाणुओं की संख्या बताइए
(a) CO32-,
(b) PO43-,
(c) P2O5,
(d) CO.
उत्तर:
(a) 4, (b) 5, (c) 7, (d) 2.
प्रश्न 7.
जल के द्रव्यमान में न्यूट्रॉनों का अंश कितना होता है ? परिकलन कीजिए।
हल:

अत: जल में न्यूट्रॉनों का अभीष्ट द्रव्यमान अंश = 4/9.
प्रश्न 8.
निम्नलिखित में से प्रत्येक को उसकी परमाणुकता के आधार पर वर्गीकृत कीजिए-.
(a) F2,
(b) NO2,
(c) N2O,
(d) CH6,
(e) P4,
(f) H2O2,
(g) P4O10,
(h) O3,
(i) HCl,
(j) CH4,
(k) He,
(l)Ag.
उत्तर:
विभिन्न पदार्थों की परमाणुकता निम्न प्रकार है-
(a) 2, (b) 3, (c) 3, (d) 8, (e) 4, (1)4, (g) 14, (h) 3, (i) 2, (j) 5, (k) l (अक्रियशील गैसों के परमाणु संयुक्त नहीं होते) (l) बहुपरमाण्विक (धातुओं के अणुओं में परमाणुओं की संख्या के सम्बन्ध में कहना कठिन है)
प्रश्न 9.
परिकलन द्वारा प्रमाणित कीजिए कि
(a) 5 मोल CO2 और 5 मोल H2O के द्रव्यमान समान नहीं होते।
(b) 240g कैल्सियम और 240 g मैग्नीशियम तत्वों का मोल अनुपात 3 : 5 है।
हल:
(a) 5 मोल CO2 का द्रव्यमान = 5 x CO2 का मोलर द्रव्यमान
= 5 x 44 = 220g
5 मोल H2O का द्रव्यमान = 5 x H2O का मोलर द्रव्यमान
= 5 x 18 = 90 g
अत: 5 मोल CO2 का द्रव्यमान और 5 मोल H2O का द्रव्यमान समान नहीं है।
(b) 240 g कैल्सियम में मोल संख्या = \(\frac { 240 }{ 40 }\) = 6 मोल
240 g मैग्नीशियम में मोल संख्या = \(\frac { 240 }{ 24 }\) = 10 मोल
अत: 240g Ca एवं 240g Mg में मोल अनुपात = 6 : 10 = 3 : 5
प्रश्न 10.
कैल्सियम क्लोराइड को जब जल में विलेय किया जाता है, तो वह निम्नलिखित समीकरण के अनुसार अपने आयनों में वियोजित हो जाता है-
CaCl2(aq) → Ca(aq)2+ + 2Cl(aq)–
CaCl2 से प्राप्त आयनों की संख्या का परिकलन कीजिए जब जल में इसके 222 g विलेय किए जाते हैं।
हल:
CaCl2 का मोलर द्रव्यमान = 40 + 2 x 35.5 = 40 + 71 = 111g
222 g CaCl2 में मोल संख्या = \(\frac { 220 g}{ 1 }\) = 2 मोल
एक अणु CaCl2 से 3 आयन प्राप्त होते हैं।
इसलिए 1 मोल CaCl से 3 मोल आयन प्राप्त होंगे।
एवं 2 मोल CaCl2 से 2 x 3 = 6 मोल आयन प्राप्त होंगे।
अब आयनों की संख्या = मोल संख्या x आवोगाद्रो संख्या
= 6 x 6.022 x 1023
= 36-132 x 1023 आयन
= 3.6132 x 1024 आयन
अतः अभीष्ट आयनों की संख्या = 3.6132 x 1024 आयन
![]()
प्रश्न 11.
प्रत्येक सोडियम परमाणु और सोडियम आयनों के 100 मोल द्रव्यमानों में अन्तर 5.48002g होता है। एक इलेक्ट्रॉन के द्रव्यमान की गणना कीजिए।
हल:
प्रत्येक सोडियम परमाणु और सोडियम आयनों के द्रव्यमान में एक इलेक्ट्रॉन के द्रव्यमान का अन्तर होता है।
इसलिए 100 मोल इलेक्ट्रॉनों का द्रव्यमान = 5.48002g

= 9.1 x 10-26g = 9.1 x 10-29 kg
अतः एक इलेक्ट्रॉन का अभीष्ट द्रव्यमान = 9.1 x 10-29 kg
प्रश्न 12.
सिल्वर (Hgs), मरकरी का एक प्रमुख अयस्क है। 225g शुद्ध HgS में कितने ग्राम मरकरी के कण विद्यमान होते हैं ? Hg और S के मोलर द्रव्यमान क्रमश: 220.6g mol-1 और 32g mol-1हैं।
हल:
HgS का मोलर द्रव्यमान = 220-6 g + 32 g = 252.6g mol-1
∵ 252.6 g Hgs में Hg का द्रव्यमान = 220.6g
∴ 225 g Hgs में Hg का द्रव्यमान = 220.6 x 225/252.6 = 196.50 g
अतः मर्करी के अभीष्ट कणों का द्रव्यमान = 196.50g
प्रश्न 13.
एक स्टील के पेंच का द्रव्यमान 4-11g है। स्टील के इन पेंचों के एक मोल का द्रव्यमान ज्ञात कीजिए। इस मान की तुलना पृथ्वी के द्रव्यमान (5.98 x 1024 kg) से कीजिए। इनमें से कौन-सा भारी है और कितना?
हल:
स्टील के पेंचों के एक मोल का द्रव्यमान = पेंच का द्रव्यमान x 1 मोल में पेंचों की संख्या
=4.11 g x 6.022 x 1023
= 2.475 x 1024 g = 2-475 x 1021 kg
चूँकि पृथ्वी का द्रव्यमान = 5.98 x 1024 kg है जो स्टील के एक मोल पेंच के द्रव्यमान से अधिक है इसलिए पृथ्वी एक मोल स्टील के पेंच से भारी है।
अब पृथ्वी का द्रव्यमान/स्टील के पेंच के एक मोल का द्रव्यमान = \(\frac{5 \cdot 980 \times 10^{24}}{2 \cdot 475 \times 10^{21}}\)
= 2.416 x 103 = 2416
अतः पृथ्वी 1 मोल स्टील पेंच से लगभग 2.416 गुना भारी है।
प्रश्न 14.
विटामिन C के एक नमूने में 2.58 x 1024 ऑक्सीजन अणु एवं ऑक्सीजन परमाणु उपस्थित हैं। इस नमूने में ऑक्सीजन परमाणुओं के कितने मोल उपस्थित हैं ?
हल:

अत: ऑक्सीजन के मोलों की अभीष्ट संख्या = 4.28
प्रश्न 15.
रौनक ने कार्बन परमाणुओं के 5 मोल एक पात्र में लिए और कृष ने सोडियम परमाणुओं के .5 मोल समान भार वाले दूसरे पात्र में लिए। (a) किसका पात्र भारी है ? (b) किसके पात्र में परमाणुओं की संख्या अधिक है ?
हल:
5 मोल कार्बन परमाणुओं का द्रव्यमान = 5 x कार्बन का परमाणु द्रव्यमान
= 5 x 12 g = 60g
5 मोल सोडियम परमाणुओं का द्रव्यमान = 5 x सोडियम का परमाणु द्रव्यमान
= 5 x 23 = 115g
(a) कृष का पात्र भारी है।
(b) दोनों के पात्रों में परमाणुओं की संख्या बराबर है क्योंकि मोल बराबर हैं।
प्रश्न 16.
दृश्य ब्रह्माण्ड में अनुमानित 1022 तारे हैं। दृश्य ब्रह्माण्ड में तारों के कितने मोल उपस्थित हैं ?
हल:

अतः दृश्य ब्रह्माण्ड में तारों के मोलों की अभीष्ट संख्या = 1.66 x 10-2 मोल
प्रश्न 17.
103 मोल मैग्नीशियम परमाणुओं तथा मैग्नीशियम आयनों के द्रव्यमानों के अन्तर का परिकलन कीजिए। (एक इलेक्ट्रॉन का द्रव्यमान = 9.1 x 10-31kg)
हल:
मैग्नीशियम के एक परमाणु एवं एक आयन के द्रव्यमानों में 2 इलेक्ट्रॉनों के द्रव्यमान के बराबर अन्तर होगा क्योंकि Mg2+ में 2 इलेक्ट्रॉन कम हैं।
103 मोल Mg परमाणु एवं Mg आयनों में इलेक्ट्रॉनों का अन्तर = 2 x 103 मोल
2 x 103 मोल इलेक्ट्रॉनों का द्रव्यमान = 2 x 103 x 6.022 x 1023 x 9.1 x 10-31kg
= 2 x 6.022 x 9.1 x 10-5
= 109.6 x 10-5 kg = 1:096 x 10-3 kg
अतः द्रव्यमानों में अभीष्ट अन्तर = 1.096 x 10-3 kg
प्रश्न 18.
5.85 g सोडियम क्लोराइड में उपस्थित आयनों की संख्या परिकलित कीजिए।
हल:
सोडियम क्लोराइड (NaCl) का आण्विक द्रव्यमान = 23 + 35.5 = 58.5g
इसलिए 5.85 g NaCl में मोल संख्या = \(\frac { 5.85 }{ 85.5 }\) = 0.1 मोल
NaCl के एक अणु में Na+ एवं Cl– के कुल दो आयन हैं।
इसलिए 5.85 g NaCl में आयनों की संख्या = 2 x 0.1 x 6.022 x 1023
= 1.2044 x 1023
अतः अभीष्ट आयनों की संख्या = 1:2044 x 1023
प्रश्न 19.
किसमें परमाणुओं की संख्या अधिक है ? (N2 के 100 g में अथवा NH3 के 100 g में)
हल:


अत: NH3 में अभीष्ट परमाणुओं की संख्या N2 से अधिक है।
![]()
प्रश्न 20.
गोल्ड के एक नमूने में 90% गोल्ड और शेष कॉपर है। मोल के इस नमूने के एक ग्राम में गोल्ड के कितने परमाणु उपस्थित हैं ?
हल:
एक ग्राम गोल्ड नमूने में शुद्ध गोल्ड = 90 = 0.9g

= \(\frac { 0.9 }{ 197 }\) = 0.0046 मोल
उपर्युक्त गोल्ड में उपस्थित परमाणु = 0.0046 x 6.022 x 1023
= 2.77 x 1021 परमाणु
अतः गोल्ड के अभीष्ट परमाणुओं की संख्या = 2.77 x 1023 परमाणु
प्रश्न 21.
आयनिक तथा आण्विक यौगिक क्या होते हैं ? उदाहरण दीजिए। (2019)
उत्तर:
आयनिक यौगिक-“वे यौगिक जो जल में घोलने पर ऋणावेशित कणों (धनायन एवं ऋणायनों) में विभक्त हो जाते हैं, आयनिक यौगिक कहलाते हैं।”
उदाहरण – सोडियम क्लोराइड, अमोनियम सल्फेट आदि।
आण्विक यौगिक – “वे यौगिक जो विभिन्न तत्वों के परमाणुओं के परस्पर एक निश्चित अनुपात में जुड़कर बनते हैं तथा जल में घोलने पर आयनों में विभक्त नहीं होते, आण्विक यौगिक कहलाते हैं।”
उदाहरण-कार्बन डाइ-ऑक्साइड, अमोनिया आदि।
प्रश्न 22.
एक मोल ऐलुमिनियम परमाणुओं और इसके एक मोल आयनों के द्रव्यमानों में अन्तर को परिकलित कीजिए। (एक इलेक्ट्रॉन का द्रव्यमान 9.1 x 10-28 g है)। इनमें से कौन-सा अधिक भारी है ?
हल:
चूँकि एक ऐलुमिनियम परमाणु A1 एवं आयन Al3+ में तीन इलेक्ट्रॉनों का अन्तर होता है।
इसलिए 1 मोल Al एवं 1 मोल Al3+ में इलेक्ट्रॉनों में अन्तर = 3 मोल
3 मोल इलेक्ट्रॉनों का द्रव्यमान = 3x 6.022 x 1023 x 9.1 x 10-28
= 1.644 x 10-3
और चूँकि परमाणु से आयन बनने में इलेक्ट्रॉन निकला है इसलिए परमाणु का द्रव्यमान आयन के द्रव्यमान से अधिक होगा।
अत: Al परमाणु एवं Al3+ आयन के द्रव्यमानों में अन्तर = 1.644 x 10-3g तथा AIपरमाणु Al3+ आयन से अधिक भारी है।
प्रश्न 23.
‘m’g द्रव्यमान के एक सिल्वर के आभूषण को सिल्वर के 1% द्रव्यमान तुल्य गोल्ड से पॉलिश किया गया। आभूषण में गोल्ड और सिल्वर के परमाणुओं की संख्याओं के अनुपात को परिकलित कीजिए।
हल:
सिल्वर का द्रव्यमान = m ग्राम
गोल्ड का द्रव्यमान = m का 1% = \(\frac { m }{ 100 }\)g

= 108 : 19700 = 1 : 182.41
अतः गोल्ड एवं सिल्वर के परमाणुओं में अभीष्ट अनुपात = 1 : 182.41
प्रश्न 24.
एथेन गैस (C2H6) के एक नमूने का वही द्रव्यमान है जो मीथेन गैस (CH4) के 1.5 x 1020अणुओं का होता है। गैस के नमूने में कितने C2H6 अणु हैं ?
हल:

अतः एथेन गैस (C2H6) के नमूने में अभीष्ट अणुओं की संख्या = 0.8 x 1020 अणु
प्रश्न 25.
निम्नलिखित के सूत्र लिखें और प्रत्येक का आण्विक द्रव्यमान परिकलित कीजिए
(a) कास्टिक पोटाश,
(b) बेकिंग पाउडर,
(c) चूने का पत्थर,
(d) कास्टिक सोडा,
(e) एथेनॉल,
(f) साधारण नमक।
उत्तर:
(a) सूत्र: KOH का आण्विक द्रव्यमान = 39 + 16 + 1 = 56
(b) सूत्र : NaHCO3 का आण्विक द्रव्यमान = 23 + 1 + 1 2 + 48 = 84
(c) सूत्र : CaCO3 का आण्विक द्रव्यमान = 40 + 12+ 48 = 100
(d) सूत्र : NaOH का आण्विक द्रव्यमान = 23 + 16 + 1 = 40
(e) सूत्र : C2H5OH का आण्विक द्रव्यमान = 24 + 5 + 16 + 1 = 46
(f) सूत्र : NaCl का आण्विक द्रव्यमान = 23 + 35.5 = 58.5
प्रश्न 26.
प्रकाश-संश्लेषण में कार्बन डाइ-ऑक्साइड के 6 अणु जल के समान संख्या में अणुओं से जटिल अभिक्रियाओं की एक श्रृंखला के माध्यम से संयोग करके C6H12O6 आण्विक सूत्र वाला ग्लूकोज का एक अणु देते हैं। 18 g ग्लूकोज बनाने के लिए कितने ग्राम जलं की आवश्यकता होगी ? जल का घनत्व 1g cm-3 मानते हुए काम में आये जल का आयतन परिकलित कीजिए।
हल:
ग्लूकोज (C6H12O6) का आण्विक द्रव्यमान = 6 x 12 + 1 x 12 + 6 x 16
= 180g
∵ 1 मोल ग्लूकोज बनाने के लिए 6 मोल जल की आवश्यकता होती है।
∴ 180 g ग्लूकोज बनाने के लिए आवश्यक जल = 6 x 18 g..
∴ 18g ग्लकोज बनाने के लिए आवश्यक जल = \(\frac { 6\times18 }{ 180 }\) x 18 g = 10.8g

अतः अभीष्ट जल का द्रव्यमान = 10-8g एवं आयतन = 10.8 cm3
![]()
MP Board Class 9th Science Chapter 3 दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
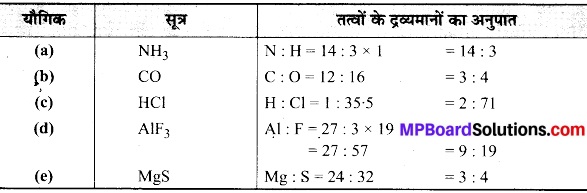
निम्नलिखित यौगिकों के रासायनिक सूत्र दीजिए और प्रत्येक के लिए उसके संयोजी तत्वों के द्रव्यमानों के सन्दर्भ में अनुपात का परिकलन कीजिए-
(a) अमोनिया (2019),
(b) कार्बन मोनोक्साइड (2019),
(c) हाइड्रोजन क्लोराइड (2019),
(d) ऐलुमिनियम फ्लुओराइड,
(e) मैग्नीशियम सल्फाइड।
हल:
प्रश्न 2.
निम्नलिखित यौगिकों के संयोजी तत्वों का उनके द्रव्यमान के सन्दर्भ में अनुपात ज्ञात कीजिए –
(a) CaCO3,
(b) MgCl2,
(c) H2SO4,
(d) C2H5OH,
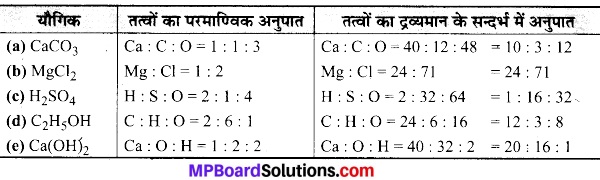
(e) Ca(OH)2.
हल: