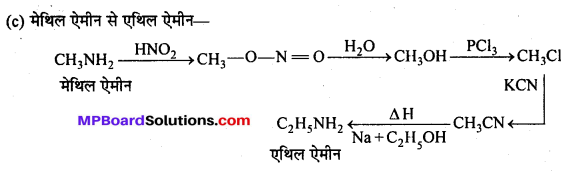
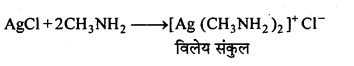
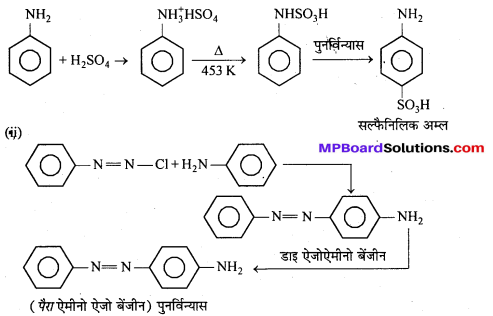
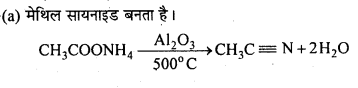
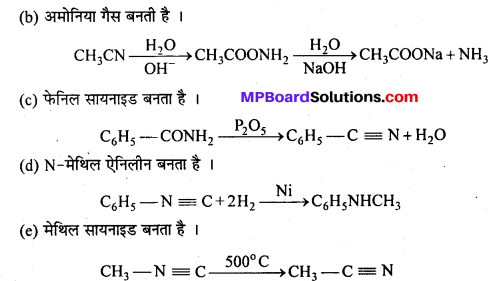
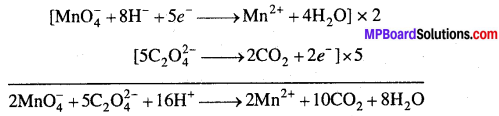
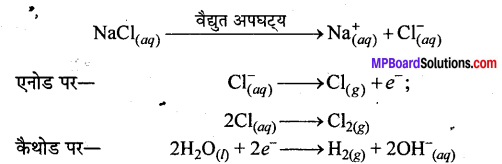
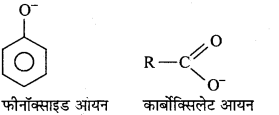
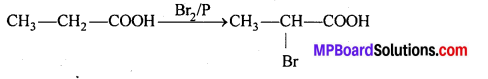
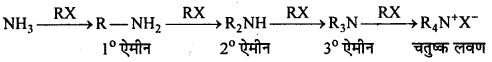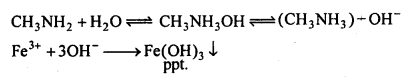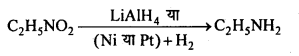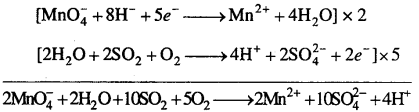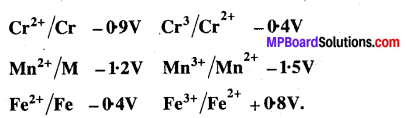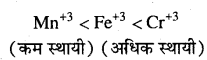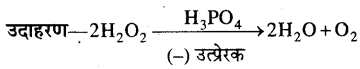MP Board Class 12th Chemistry Solutions Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
हैलोऐल्केन तथा हैलोऐरीन NCERT पाठ्यनिहित प्रश्नोत्तर
प्रश्न 1.
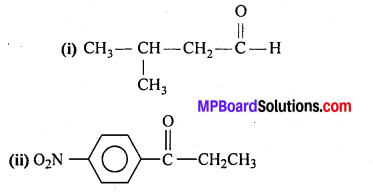
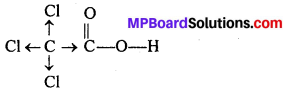
निम्नलिखित यौगिकों की संरचनाएँ लिखिए –
(i) 2 – क्लोरो 3 – मेथिलपेन्टेन
(ii) 1- क्लोरो 4- एथिलसाइक्लोहेक्सेन।
(iii) 4-तृतीयक ब्यूटिल 3 – आयोडोहेप्टेन।
(iv) 1, 4 डाइब्रोमोब्यूट 2 – ईन
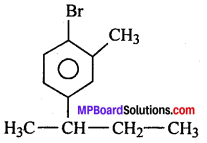
(v) 1 – ब्रोमो 4 – द्वितीयक ब्यूटिल 2 – मेथिलबेंजीन
उत्तर
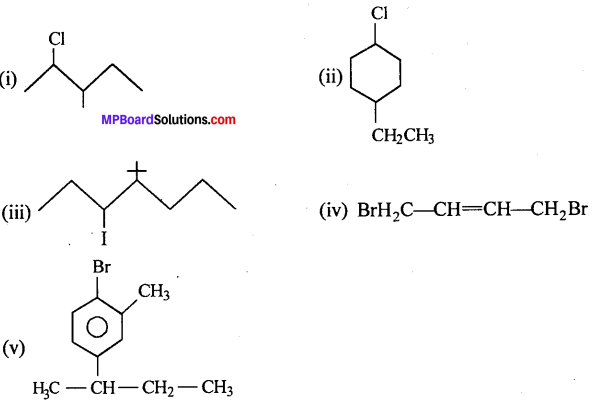
![]()
प्रश्न 2.
एल्कोहॉल तथा KI की अभिक्रिया में सल्फ्यूरिक अम्ल का उपयोग क्यों नहीं करते हैं ?
उत्तर
H2SO4 एक ऑक्सीकारक है। ये HI को I2 में ऑक्सीकृत करता है तथा एल्कोहॉल तथा HI के बीच अभिक्रिया को रोकता है। जिनमें ये एल्काइल आयोडाइड बनाते हैं।
KI + H2SO4 → KHSO4 + HI
2HI + H2SO4 → I2 + 2H2O+ SO2).
इस कठिनाई को दूर करने के लिये अभिकर्मक जो ऑक्सी-कारक न हो जैसे-H3PO4, H2SO4 की जगह उपयोग करते हैं।
प्रश्न 3.
प्रोपेन के विभिन्न डाइ हैलोजन व्युत्पन्नों की संरचना लिखिए।
उत्तर
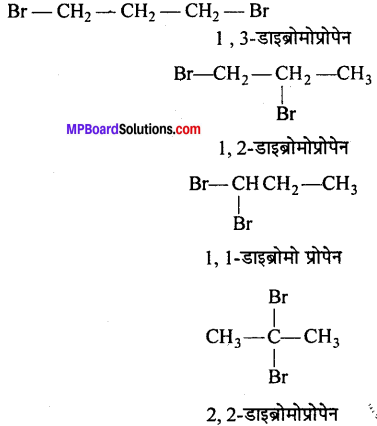
प्रश्न 4.
C5H12 अणुसूत्र वाले समावयवी एल्केनों में से उसको पहचानिये जो प्रकाश रासायनिक – क्लोरीनीकरण पर देता है।।
(i) केवल एक मोनोक्लोराइड
(ii) तीन समावयवी मोनोक्लोराईड
(iii) चार समावयवी मोनोक्लोराइड।
उत्तर
(i)

(ii)
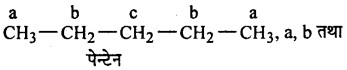
c हाइड्रोजन के विस्थापन से चार मोनोक्लोराइड समावयवी देगा।
(iii)
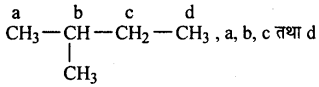
हाइड्रोजन परमाणुओं के विस्थापन से चार समावयवी मोनो-क्लोराइड देता है।
प्रश्न 5.
निम्नलिखित प्रत्येक अभिक्रिया के मुख्य मोनोहैलो उत्पाद की संरचना बनाइए –
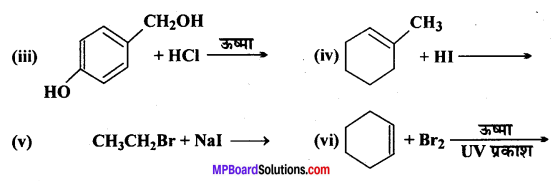
उत्तर
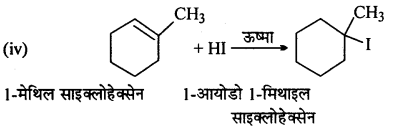

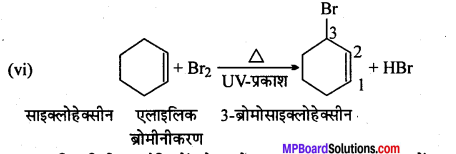
प्रश्न 6.
निम्नलिखित यौगिकों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित कीजिए –
(i) ब्रोमोमेथेन, ब्रोमोफॉर्म, क्लोरोमेथेन, डाइब्रोमोमेथेन।
(ii) 1-क्लोरोप्रोपेन, आइसोप्रोपिल क्लोराइड, 1-क्लोरो ब्यूटेन।
उत्तर
(a) समान एल्किल समूह के लिये उनके क्वथनांक हैलोजन परमाणु के अणुभार बढ़ने के साथ बढ़ते हैं।
(b) समान हैलोजन के लिये शाखा बढ़ने के साथ क्वथनांक घटते हैं। इस आधार पर निम्न क्रम की भविष्यवाणी की जाती है।
(i) क्लोरोमेथेन < ब्रोमोमेथेन < डाइक्लोरोमेथेन < ब्रोमोफॉर्म
(ii) ऑइसोप्रोपाइल क्लोराइड < 1-क्लोरोप्रोपेन < 1-क्लोरो-ब्यूटेन।
![]()
प्रश्न 7.
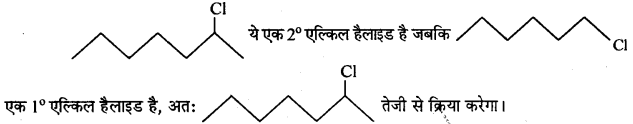
निम्नलिखित युग्मों में से आप कौन-से ऐल्किल हैलाइड द्वारा SN2 क्रियाविधि से अधिक तीव्रता से अभिक्रिया करने की अपेक्षा करते हैं ? अपने उत्तर को समझाइए।
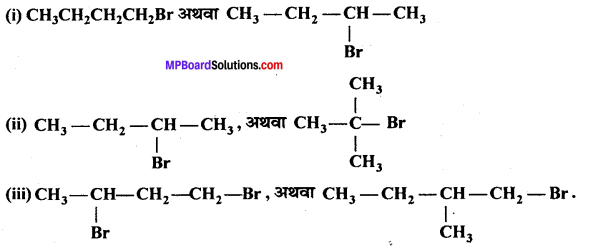
उत्तर
यदि किसी निश्चित सूत्र के विभिन्न समावयवियों में निकलने वाले समूह समान हों, तो समावयवियों की क्रियाशीलता SN2 अभिक्रिया के लिये त्रिविम बाधा के साथ घटती है।
(i) CH3CH2CH2CH2Br एक 1° एल्किल हैलाइड है,

(ii)

तेजी से क्रिया करती है क्योंकि 3° एल्किल हैलाइड में ज्यादा त्रिविम बाधा (2° से) होती है।
(iii)

ये 1° एल्किल हैलाइड है, परन्तु (II) में CH, समूह C, परमाणु पर है जो Br के निकट है (ज्यादा त्रिविम बाधा उत्पन्न करता है) जो C,
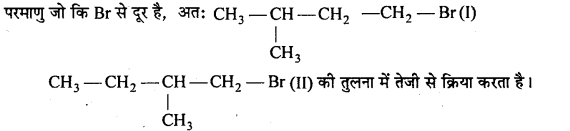
प्रश्न 8.
हैलोजन यौगिकों के निम्नलिखित युग्मों में से कौन-सा यौगिक तीव्रता से SNI अभिक्रिया करेगा –
(i)
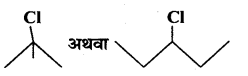
(ii)

उत्तर
एल्किल हैलाइड की S1 अभिक्रिया की क्रियाशीलता माध्यमिक कार्बोकेटायन के स्थायित्व पर निर्भर करती है – 3°>2° >1°
(i)
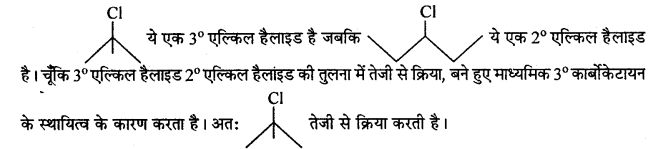
(ii)
![]()
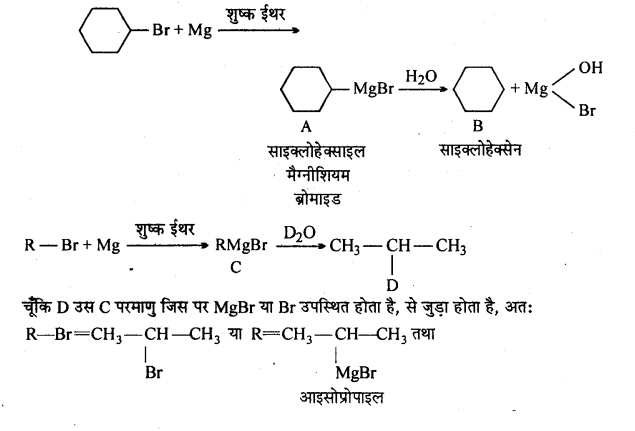
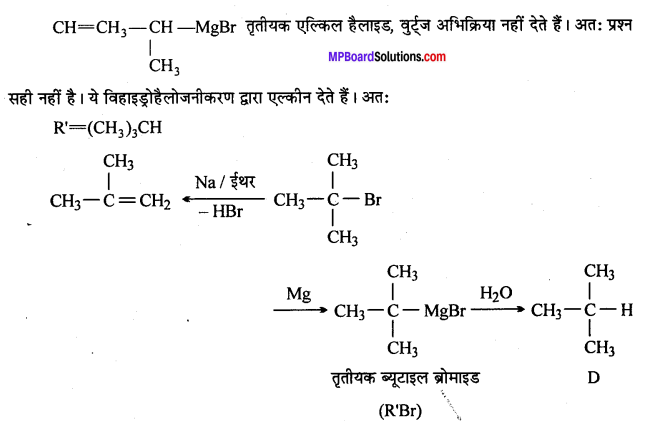
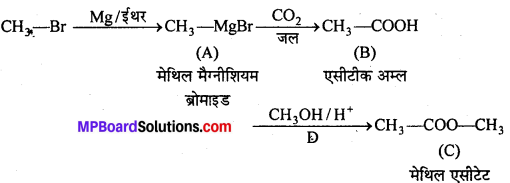
प्रश्न 9.
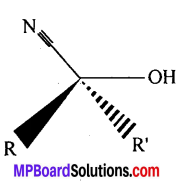
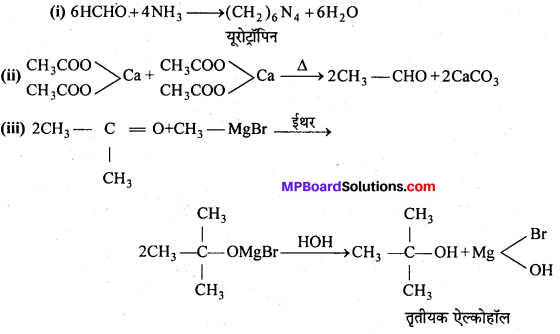
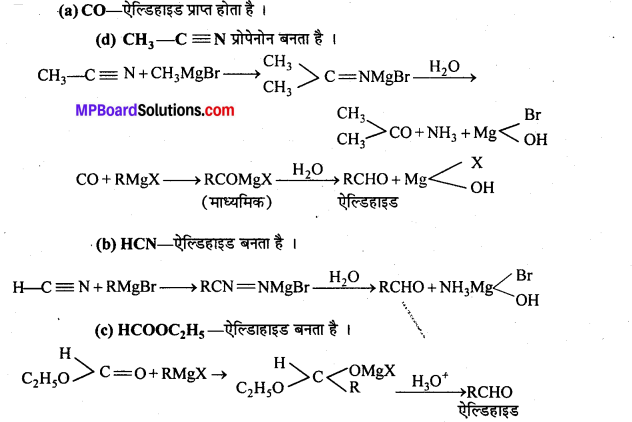
निम्नलिखित में A, B, C, D, E, R तथा R’ को पहचानिये: –
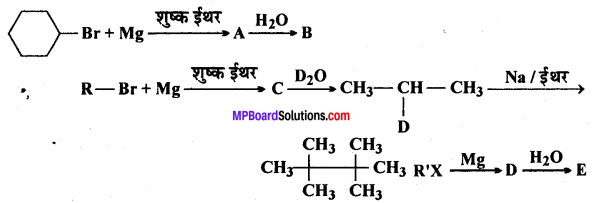
चूंकि D उस C परमाणु जिस पर MgBr या Br उपस्थित होता है, से जुड़ा होता है, अतः
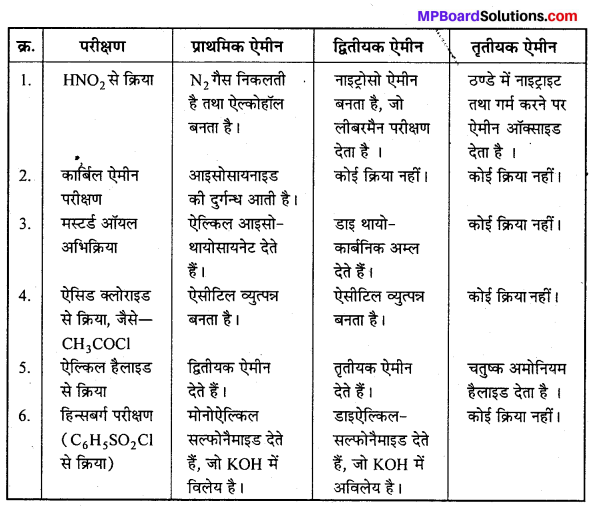
हैलोऐल्केन तथा हैलोऐरीन NCERT पाठ्य-पुस्तक प्रश्नोत्तर
प्रश्न 1.
निम्नलिखित हैलाइडों के नाम आई.यू.पी.ए.सी. पद्धति से लिखिए तथा उनका वर्गीकरण, ऐल्किल ऐलाइलिक, बेन्जाइलिक (प्राथमिक, द्वितीयक एवं तृतीयक) वाइनिल अथवा ऐरिल हैलाइड . के रूप में कीजिए –
(i) (CH3)2CHCH(Cl)CH3
(ii) CH3CH2CH(CH3)CH(C2H5)Cl
(iii) CH3CH2C(CH3)2CH2I
(iv) (CH3)3CCH2CH(Br) C6H5
(v) CH3CH(CH3)CH(Br)CH3
(vi) CH3C(C2H5)2CH2Br
(vii) CH3C(Cl)(C2H5)CH2CH3
(viii) CH3CH = C(Cl)CH2CH(CH3)2
(ix) CH3CH = CHC(Br) (CH3) 2
(x) p-ClC6H4CH2CH(CH3)2
(xi) m-ClCH2C6H4CH2C(CH3)3
(xii) o-Br-C6H4CH(CH3)CH2CH3
उत्तर
(i) 2-क्लोरो 3-मिथाइलब्यूटेन (2° एल्काइल)
(ii) 3-क्लोरो 4-मिथाइलहेक्सेन (2° एल्काइल)
(iii) 1-आयोडो 2, 2-डाइमिथाइलब्यूटेन (1° एल्काइल)
(iv) 1-ब्रोमो 3, 3-डाइमिथाइल 1-फिनाइल ब्यूटेन (2° बेन्जाइलिक)
(v) 2-ब्रोमो 3-मिथाइलब्यूटेन (2° एल्काइल)
(vi) 3-ब्रोमोमिथाइल 3-मिथाइलपेन्टेन (1° एल्काइल)
(vii) 3-क्लोरो 3-मिथाइलपेन्टेन (3° एल्काइल)
(viii) 3-क्लोरो 5-मिथाइल हेक्स -2-ईन (विनाइल)
(ix)4-ब्रोमो 4-मिथाइल पेन्ट -2- ईन (एलाइलिक)
(x) 1-क्लोरो 4-(2 मिथाइल-प्रोपाइल) बेंजीन (एराइल) या p-क्लोरो आइसोब्यूटाइल बेंजीन
(xi) 1-क्लोरोमिथाइल 3-(2’2′ डाइइथाइल प्रोपाइल) बेंजीन (बेन्जाइलिक) या m-नियोपेन्टाइल बेंजाइल क्लोराइड
(xii) 1-ब्रोमो 2-(1 मिथाइल प्रोपाइल) बेंजीन (एराइल)।
प्रश्न 2.
निम्नलिखित यौगिकों के IUPAC नाम दीजिए –
(i) CH3CH(Cl)CH(Br)CH3
(ii) CHF2CBrClF
(iii) ClCH2C ≡ CCH2Br
(iv) (CCl3)3CCl
(v) CH3C(p-CIC6H4)2CH(Br)CH3
(vi) (CH3)3CCH =ClC6H4I-p
उत्तर
(i)2-ब्रोमो 3- क्लोरोब्यूटेन
(ii) 1-ब्रोमो 1-क्लोरो 1, 2, 2 ट्राइफ्लुओरोएथेन
(iii) 1-ब्रोमो 4- क्लोरोब्यूट-2-आइन
(iv) 1, 1, 1, 2, 3, 3, 3 हेप्टाक्लोरो 2-(ट्राइक्लोरोमिथाइल) प्रोपेन
(v) 3-ब्रोमो 2, 2 बिस (4′- क्लोरोफिनाइल) ब्यूटेन
(vi) 1-क्लोरो 1-(4′-आयोडोफिनाइल) 3, 3-डाइमिथाइल ब्यूट -1-ईन।।
![]()
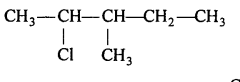
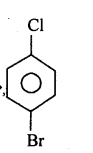
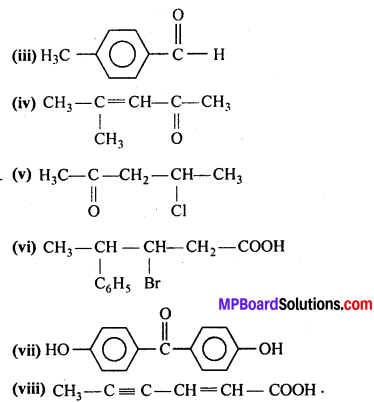
प्रश्न 3.
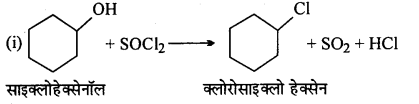
निम्नलिखित कार्बनिक हैलोजन यौगिकों की संरचना दीजिए(i) 2-क्लोरो 3-मेथिलपेन्टेन ।
(ii)p-ब्रोमो क्लोरोबेन्जीन
(ii) 1-क्लोरो 4-एथिलसाइक्लोहेक्सेन
(iv) 2-(2-क्लोरोफेनिल)-1-आयोडोऑक्टेन
(v) परफ्लुओरोबेन्जीन
(vi) 4-तृतीयक ब्यूटिल 3-आयोडोहेप्टेन
(vii) 1-ब्रोमो 4-द्वितीयक ब्यूटिल 2-मेथिल बेन्जीन
(viii) 1, 4-डाइब्रोमोब्यूट-2-ईन।
उत्तर
(i)
(ii)
(iii)
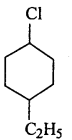
(iv)
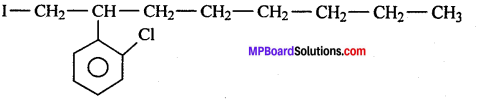
(v)
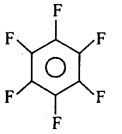
(vi)
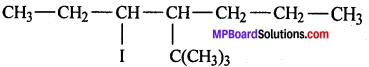
(vii)
(viii)
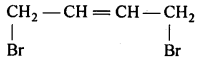
प्रश्न 4.
निम्नलिखित में से किसका द्विध्रुव आघूर्ण सर्वाधिक होगा –
(1) CH2Cl2
(ii) CHCl3
(iii) CCl4
उत्तर
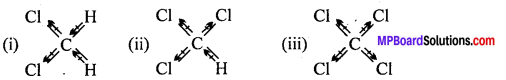
CCl4 (iii) सममित हैं, तथा परिणामी द्विध्रुव आघूर्ण शून्य है। CHCl3 (ii) में दो C-Cl का परिणामी द्विध्रुव C-H तथा C-Cl बंध के परिणामी द्विध्रुव द्वारा विरोध किया जाता है। इसलिये अन्तिम अनुमानित परिणामी द्विध्रुव पहले से कम होगा, इसलिये CHCl3 में निश्चित द्विध्रुव-आघूर्ण (1.03 D) होगा। CH2Cl2 (j) में दो C-Cl का परिणामी द्विध्रुव आघूर्ण दो C-H द्विध्रुवों के परिणामी द्विध्रुव की अपेक्षा मजबूत होता है। अत: CH2Cl2 (1.62 D) का द्विध्रुव आघूर्ण CHCl3 से ज्यादा होगा।
अर्थात् CH2Cl2 में उच्चतम द्विध्रुव आघूर्ण होगा।
प्रश्न 5.
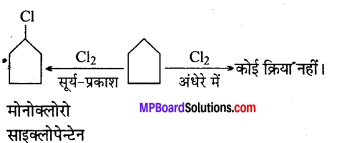
एक हाइड्रोकार्बन C5H10 अंधेरे में क्लोरीन के साथ अभिक्रिया नहीं करता परन्तु सूर्य के तीव्र प्रकाश में केवल एक मोनोक्लोरो यौगिक C5H9Cl देता है। हाइड्रोकार्बन की संरचना क्या है ?
उत्तर
(i) अणुसूत्र यह सुझाव देता है कि यह या तो साइक्लो-एल्केन है या एल्केन। .
(ii) क्योंकि हाइड्रोकार्बन Cl2 के साथ अंधेरे में क्रिया नहीं करते, अतः ये एल्केन नहीं होंगे। ये साइक्लोएल्केन होंगे। .
(iii) हाइड्रोकार्बन Cl2 से तीव्र सूर्य के प्रकाश की उपस्थिति में क्रिया केर एकल मोनोक्लोरो यौगिक C5H9Cl देगा, अतः सभी 10-H परमाणु साइक्लोएल्केन में समतुल्य होंगे।
![]()
प्रश्न 6.
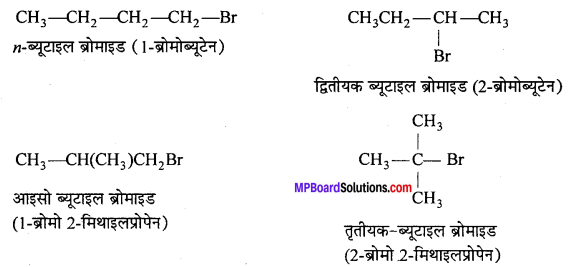
C4H9Br सूत्र वाले यौगिक के सभी समावयवी लिखिए।
उत्तर
C4H9Br के सभी समावयवी उनके साधारण नामों के साथ नीचे दिये गये हैं –
प्रश्न 7.
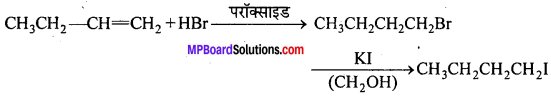
निम्नलिखित से 1-आयोडोब्यूटेन प्राप्त करने की समीकरण दीजिए –
(i) 1-ब्यूटेनॉल
(ii) 1-क्लोरोब्यूटेन
(iii) ब्यूट-1-इन
उत्तर
(i)
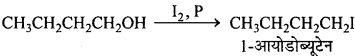
(ii)
![]()
(iii)
प्रश्न 8.
उभयधर्मी न्यूक्लियोफाइल क्या होते हैं ? एक उदाहरण की सहायता से समझाइए।
उत्तर
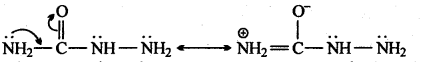
वे न्यूक्लियोफाइल जिनमें दो न्यूक्लियोफिलिक केन्द्र होते हैं, उभयधर्मी न्यक्लियोफाइल कहलाते हैं । उदाहरण, सायनाइड समूह है क्योंकि यह C या N दोनों तरफ से आक्रमण कर निम्न अनुनादी संरचनाओं के कारण कर सकता है –
![]()
प्रश्न 9.
निम्नलिखित में प्रत्येक युगलों में से कौन-सा यौगिक OF के साथ S2 अभिक्रिया में अधिक तीव्रता से अभिक्रिया करेगा –
(i) CH3Br अथवा CH3I
(ii) (CH3)3CCl अथवा CH3Cl
उत्तर
(i) CH3I, OH– के साथ SN2 अभिक्रिया तेजी से करता है। क्योंकि I– आयन Br– आयन की तुलना में अच्छा निर्मोची या निकलने वाला समूह अपने बड़े आकार के कारण है।
(ii) CH3Cl, (CH3)3CCl में उपस्थित त्रिविम बाधा के कारण इसकी तुलना में तेजी से क्रिया करता है।
![]()
प्रश्न 10.
निम्नलिखित हैलाइडों के एथेनॉल में सोडियम विहाइड्रोहैलोजन के फलस्वरूप बनने वाली सभी ऐल्कीनों की संरचना लिखिए। इसमें से मुख्य ऐल्कीन कौन-सी होगी –
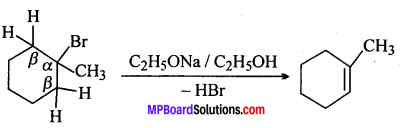
(i) 1-ब्रोमो 1-मेथिलसाइक्लोहेक्सेन
(ii) missing content
उत्तर
(i) 1-ब्रोमो 1-मिथाइलसाइक्लोहेक्सेन में Br परमाणु के दोनों तरफ की β– हाइड्रोजन समतुल्य होती है, अतः केवल 1-एल्कीन बनेगा।
(ii)
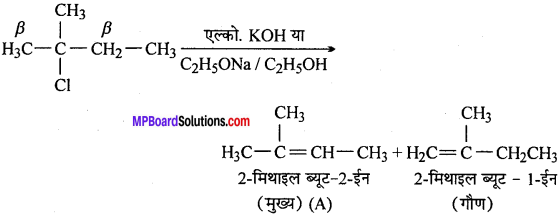
क्योंकि एल्कीन (A) सेटजैफ नियमानुसार ज्यादा प्रतिस्थापित होगी। अतः यह ज्यादा स्थायी होगी तथा मुख्य उत्पाद होगा।
(iii)
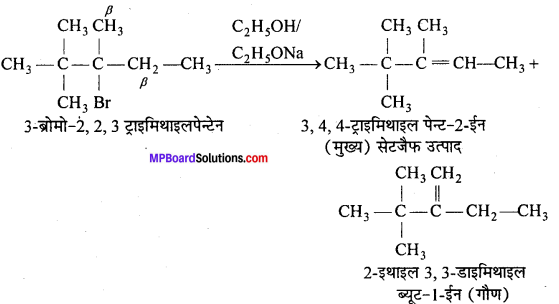
प्रश्न 11.
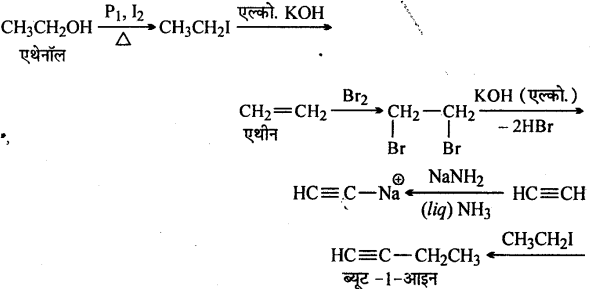
निम्नलिखित परिवर्तन आप कैसे करेंगे(i) एथेनॉल से ब्यूट-1-आइन
(ii) एथीन से ब्रोमोएथेन
(ii) प्रोपीन से 1-नाइट्रोप्रोपेन
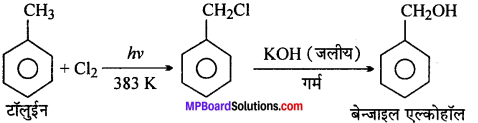
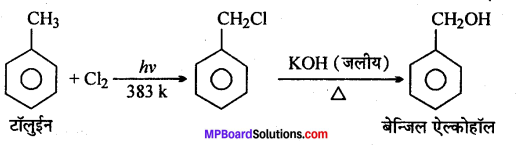
(iv) टॉलुईन से बेन्जिल ऐल्कोहॉल
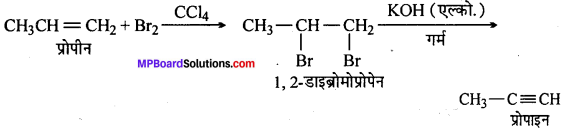
(v) प्रोपीन से प्रोपाइन
(vi) एथेनॉल से एथिल फ्लुओराइड
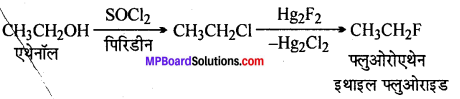
(vii) ब्रोमोमेथेन से प्रोपेनोन
(viii) ब्यूट-1-ईन से ब्यूट-2-ईन
(ix) 1-क्लोरोब्यूटेन से n-ऑक्टेन
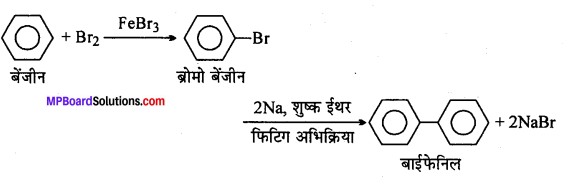
(x) बेन्जीन से बाइफेनिल।
उत्तर
(i)
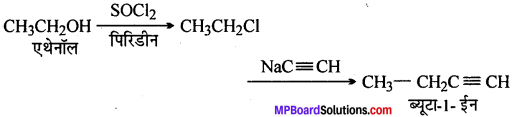
(ii)
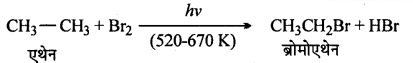
(iii)
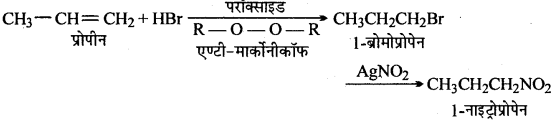
(iv)
(v)
(vi)
![]()
(vii)
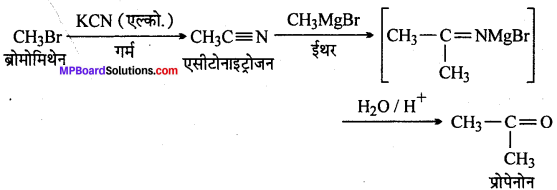
(viii)
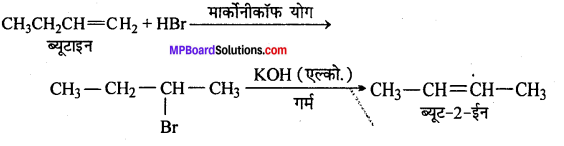
(ix)

(x)
प्रश्न 12.
समझाइए क्यों –
(i) क्लोरोबेन्जीन का द्विध्रुव आघूर्ण साइक्लोहेक्सिल क्लोराइड की तुलना में कम होता है ?
(ii) ऐल्किल हैलाइड ध्रुवीय होते हुए भी जल में अमिश्रणीय है ?
(iii) ग्रिगनार्ड अभिकर्मक का विरचन निर्जलीय अवस्थाओं में करना चाहिए?
उत्तर
(i)

क्लोरोबेंजीन में sp2 संकरित कार्बन होने के कारण, C – परमाणु ज्यादा विद्युत्ऋणात्मक होता है। (ज्यादा-s-लक्षण) जबकि साइक्लोहेक्साइल क्लोराइड, C-परमाणु sp’ संकरित अर्थात् कम विद्युत्ऋणी (कमs-लक्षण) होता है। इसलिये क्लोरोबेंजीन में C-Clबंध की ध्रुवता साइक्लोहेक्साइल क्लोराइड के C-Cl
बंध से कम हो जाती है। इसके अलावा Cl परमाणु के एकाकी इलेक्ट्रॉन युग्म के बेंजीन रिंग पर विस्थापनीकरण के कारण क्लोरोबेंजीन में C-Cl बंध पर आंशिक द्विबंध लक्षण आ जाता है जबकि C-Cl बंध साइक्लोहेक्साइल क्लोराइड पर शुद्ध एकल बंध होता है। अतः क्लोरोबेंजीन में C-Cl बंध साइक्लोहेक्साइल क्लोराइड से कम होता है। द्विध्रुव-आघूर्ण आवेश तथा दूरी का गुणनफल होता है। अतः क्लोरोबेंजीन का द्विध्रुव-आघूर्ण साइक्लोहेक्साइल क्लोराइड से कम होता है।
(ii) पानी के अणु में पर्याप्त प्रबल अन्तरआण्विक हाइड्रोजन बंध होता है जिसे तोड़ना एल्किल हैलाइड के लिये कठिन होता है, जो ध्रुवीय स्वभाव के होते हैं। अतः एल्किल हैलाइड पानी में नहीं घुलते तथा अलग परत बनाते हैं।
(iii) ग्रिगनार्ड अभिकर्मक पानी द्वारा तुरन्त विघटित होकर एल्केन बनाते हैं। इसी कारण इन्हें निर्जलीय दशा में बनाया जाता है। इसके बदले में ईथर से-ग्रिगनार्ड अभिकर्मक बनाते समय विलायक की तरह उपयोग करते हैं।
![]()
प्रश्न 13.
फ्रिऑन-12, DDT, कार्बनटेट्राक्लोराइड तथा आयोडोफॉर्म के उपयोग लिखिए।
उत्तर
फ्रिऑन-12-(i) इसे घरेलू रेफ्रिजरेटर में कूलिंग एजेन्ट के रूप में उपयोग किया जाता है।
(ii) ऐरोसॉल में नोदक के रूप में उपयोग किया जाता है।
डी. डी. टी.-यह एक शक्तिशाली कीटनाशी (Insecticide) और माइटीनाशी है। इसका प्रमुख उपयोग मलेरिया फैलाने वाले मच्छरों को नष्ट करने में होता है। यह स्थायी होता है अंतः वातावरण में बहुत समय तक उपस्थित रहकर प्रदूषण उत्पन्न करता है। मनुष्यों, पक्षियों और मछलियों की कुछ प्रजातियों पर इसका विषैला प्रभाव होता है। आजकल यू.एस.ए. तथा यूरोपीय देशों में इसका प्रयोग प्रतिबन्धित है।
कार्बनटेट्राक्लोराइड – (i) आग बुझाने के लिये पाइरीन के नाम से।
(ii) CHCl तथा फ्रिऑन के औद्योगिक निर्माण में उपयोग किया जाता है।
(iit) तेल, वसा तथा रेजिन के लिये औद्योगिक विलायक के रूप में, इसके इस गुण के कारण ड्राइक्लीनिंग में भी इसका उपयोग होता है।
(iv) हुकवर्म को निकालने के लिए दवाई के रूप में।
आयोडोफॉर्म-इसका उपयोग पहले एंटीसेप्टिक के रूप में किया जाता था, लेकिन इसका यह एंटीसेप्टिक का गुण मुक्त आयोडीन के कारण है, अतः इसकी आपत्तिजनक गंध के कारण भी इसको अन्य रूपों में बदल दिया गया है, जिसमें आयोडीन समाहित हो।
प्रश्न 14.
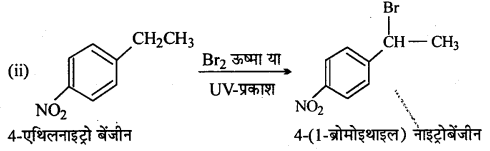
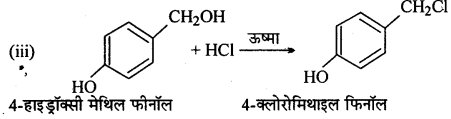
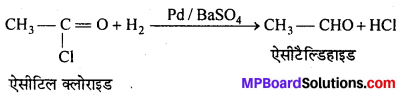
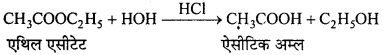
निम्नलिखित की प्रत्येक अभिक्रिया में बनने वाले मुख्य कार्बनिक उत्पाद की संरचना लिखिए –
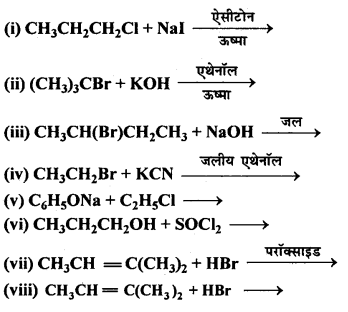
उत्तर

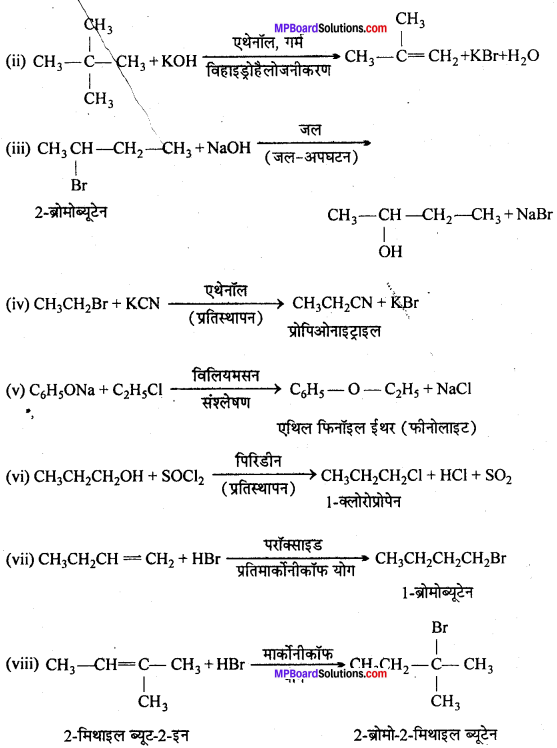
![]()
प्रश्न 15.
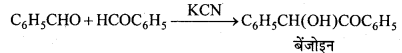
निम्नलिखित अभिक्रिया की क्रियाविधि लिखिए –
![]()
उत्तर
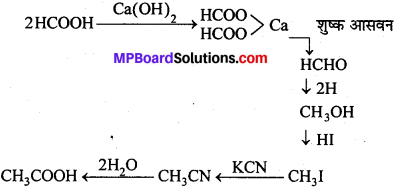
KCN जलीय माध्यम में CN– न्यूक्लियोफाइल आयन देता है, जो निम्न का अनुनादी संकर होता है –
![]()
चूँकि CN– आयन उभयधर्मी न्यूक्लियोफाइल होता है। अतः ये n-ब्यूटाइल ब्रोमाइड के C-Br बंध की C-परमाणु पर दोनों तरफ अर्थात् या तो C-परमाणु या N-परमाणु की तरफ से आक्रमण करता है। अतः दो संभावित उत्पाद क्रमशः सायनाइड व आइसोसायनाइड होंगे।
परन्तु C-C बंध, C-N बंध की तुलना में ज्यादा स्थायी होता है। अतः आक्रमण C-परमाणु की तरफ से होता है अतः प्रमुख्यतः सायनाइड बनते हैं।
![]()
प्रश्न 16.
SN2 प्रतिस्थापन के प्रति अभिक्रियाशीलता के आधार पर इन यौगिकों के समूहों को क्रमबद्ध कीजिए।
(i) 2-ब्रोमो 2-मेथिलब्यूटेन, 1-ब्रोमोपेन्टेन, 2-ब्रोमोपेन्टेन
(ii) 1-ब्रोमो 3-मेथिलब्यूटेन, 2-ब्रोमो 2-मेथिलब्यूटेन, 3-ब्रोमो 2-मेथिलब्यूटेन।
(iii) 1-ब्रोमोब्यूटेन, 1-ब्रोमो 2, 2-डाइमेथिलप्रोपेन, 1-ब्रोमो 2-मेथिलब्यूटेन, 1-ब्रोमो 3-मेथिलब्यूटेन।
उत्तर
SN2 अभिक्रिया की क्रियाशीलता त्रिविम बाधा पर निर्भर करती है। त्रिविम बाधा जितनी ज्यादा होगी क्रियाशीलता उतनी कम होगी। अतः विभिन्न एल्किल हैलाइड की SN2 क्रिया के प्रति क्रियाशीलता होती। 1°>2°>3°.

प्रश्न 17.
C6H5CH2Cl तथा C6H5CHClC6H5 में से कौन-सा यौगिक जलीय KOH से शीघ्रता से जल-अपघटित होगा?
उत्तर
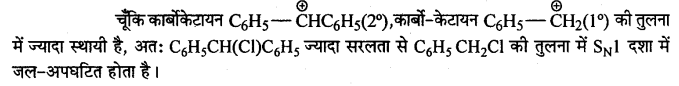
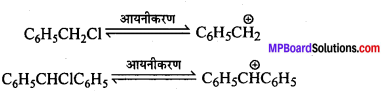
अत: SN2 क्रियाविधि में अभिक्रिया की क्रियाशीलता त्रिविम बाधा पर निर्भर करती है। अतः C6H5CH2Cl, C6H5CHClC6H5 की तुलना में SN2 दशा में सरलता से जल-अपघटित होता है।
प्रश्न 18.
p-तथा m-समावयवियों की तुलना में p-डाइक्लोरो-बेन्जीन का गलनांक एवं विलेयता उच्च होती है, विवेचना कीजिए।
उत्तर
p-क्लोरोबेंजीन का गलनांक उसके संगत o-तथा m-समावयवी से ज्यादा उच्च होती है जिसके कारण वह क्रिस्टल जालक में o या m-समावयवी की तुलना में फिट हो जाते हैं । अतः इनमें प्रबल अन्तराआण्विक आकर्षण बल ० तथा m-समावयवी से प्रबल होता है m-समावयवी में o-तथा क्रिस्टल जालक को घोलने या तोड़ने के लिये ज्यादा ऊर्जा की आवश्यकता होती है। दूसरे शब्दों में p-समावयवी का गलनांक उच्च तथा उसकी विलेयता संगत m तथा ०-समावयवी से कम होते हैं।
![]()
प्रश्न 19.
निम्नलिखित परिवर्तन कैसे सम्पन्न किए जा सकते हैं ?
(i) प्रोपीन से प्रोपेन -1- ऑल
(ii) एथेनॉल से ब्यूट -1-आइन
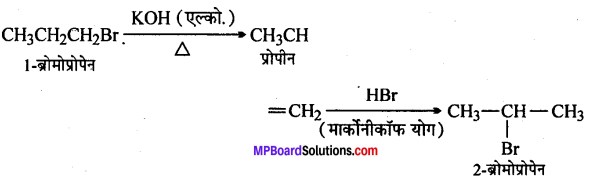
(iii) 1-ब्रोमोप्रोपेन से 2-ब्रोमोप्रोपेन
(iv) टॉलुईन से बेन्जिल ऐल्कोहॉल
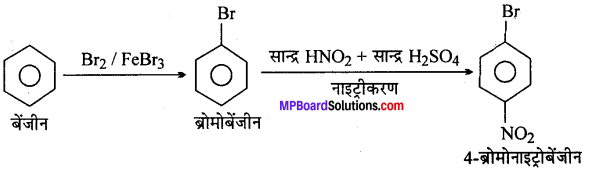
(v) बेन्जीन से 4-ब्रोमोनाइट्रोबेन्जीन
(vi) बेन्जिल ऐल्कोहॉल से 2-फेनिल एथेनोइक अम्ल
(vii) एथेनॉल से प्रोपेन नाइट्राइल
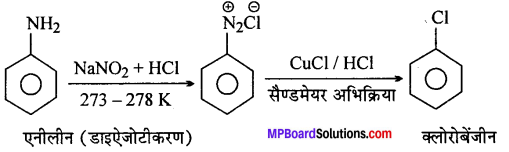
(viii) एनिलीन से क्लोरोबेन्जीन
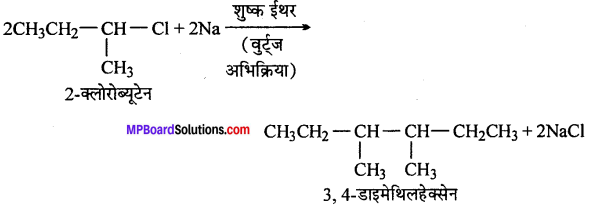
(ix) 2-क्लोरोब्यूटेन से 3, +डाइमेथिलहेक्सेन
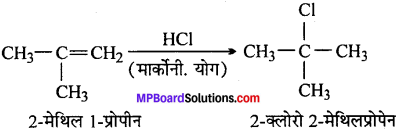
(x) 2-मेथिल 1-प्रोपीन से 2-क्लोरो 2-मेथिलप्रोपेन
(xi) एथिल क्लोराइड से प्रोपेनोइक अम्ल
(xii) ब्यूट-1-ईन से n-ब्यूटिल आयोडाइड
(xiii) 2-क्लोरोप्रोपेन से 1-प्रोपेनॉल
(xiv) आइसोप्रोपिल ऐल्कोहॉल से आयोडोफॉर्म
(xv) क्लोरोबेन्जीन से p-नाइट्रोफीनॉल
(xvi) 1-ब्रोमोप्रोपेन से 2-ब्रोमोप्रोपेन
(xvii) क्लोरोएथेन से ब्यूटेन
(xviii) बेन्जीन से डाइफेनिल
(xix) तृतीयक-ब्यूटिले ब्रोमाइड से आइसो-ब्यूटिल ब्रोमाइड
(xx) ऐनिलीन से फेनिलआइसोसायनाइड।
उत्तर
(i)
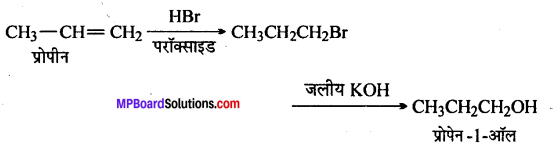
(ii)
(iii)
(iv)
(v)
(vi)
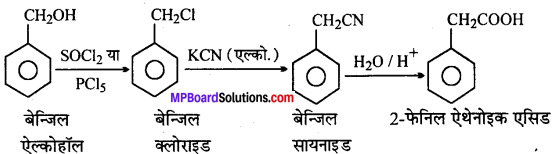
(vii)

(viii)
(ix)
(x)
![]()
(xi)
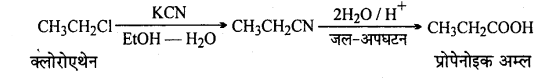
(xii)

(xiii)
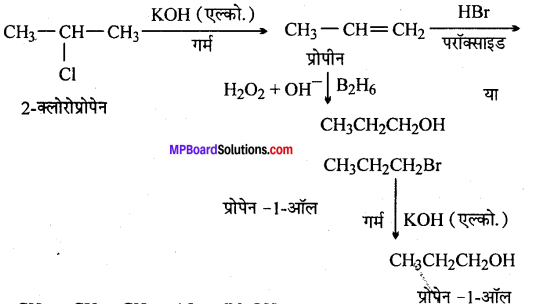
(xiv)
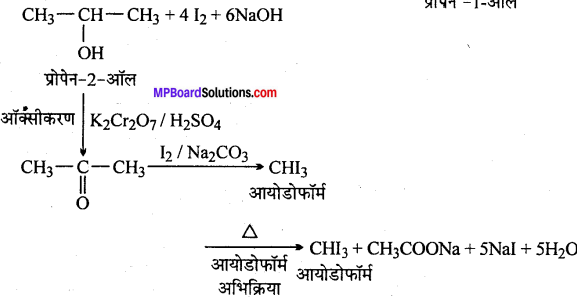
(xv)
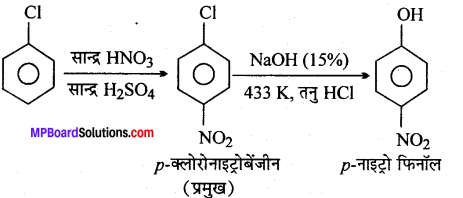
(xvi)
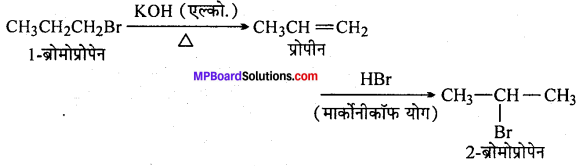
(xvii)

(xviii)
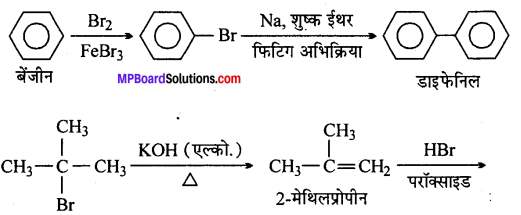
(xix)

(xx)
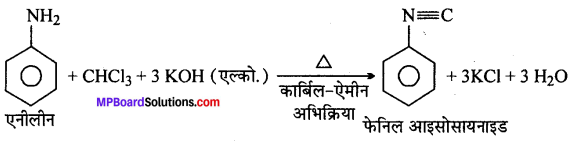
![]()
प्रश्न 20.
ऐल्किल क्लोराइड की जलीय KOH से अभिक्रिया द्वारा ऐल्कोहॉल बनता है लेकिन ऐल्कोहॉलिक KOH की उपस्थिति में ऐल्कीन मुख्य उत्पाद के रूप में प्राप्त होती है। समझाइए।
उत्तर- पानी की उपस्थिति में KOH पूर्णतः वियोजित होकर OH– देता है जो एल्किल हैलाइड में प्रतिस्थापन के लिये प्रबल न्यूक्लियोफाइल का काम करके एल्किल हैलाइड से एल्कोहॉल बनाता है। इसके अलावा जलीय विलयन में OH– आयन ज्यादा वियोजित (जलयोजित) होते हैं । ये जलयोजन OH– आयन के क्षारीय गुण को कम करता है, जो एल्किल हैलाइड की β-कार्बन से प्रोटॉन का अपोहन कर एल्कीन बनाने में असफल हो जाता है। एल्कोहॉलीय माध्यम में (H2O से कम ध्रुवीय) OH– कम जलयोजित होते हैं, अतः प्रबल क्षार की तरह कार्य करते हैं तथा β-कार्बन से प्रोटॉन निकालकर एल्कीन मुख्य उत्पाद (विहाइड्रो-हैलोजनीकरण) बनाता है। इसके अलावा एल्कोहॉलीय विलयन में OH आयन के अलावा एथॉक्साइड आयन C2H5O– है जो OH से प्रबल क्षार है, तथा प्रोटॉन त्याग कर एल्कीन बनाता है।
प्रश्न 21.
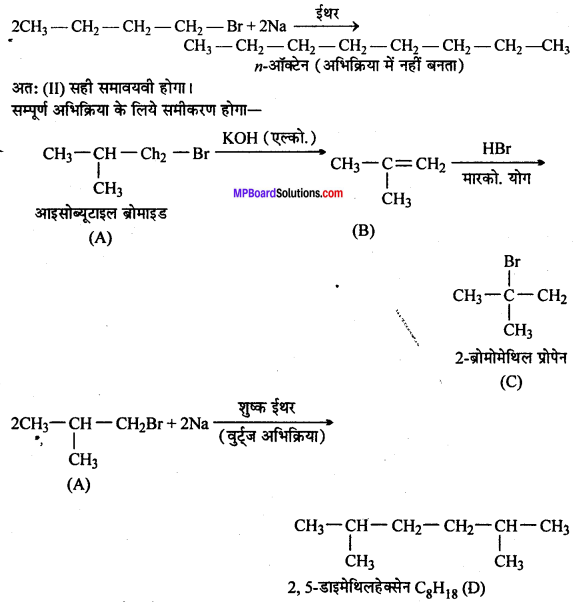
प्राथमिक से ऐल्किल हैलाइड C4H9Br (A), ऐल्कोहॉलिक KOH से अभिक्रिया द्वारा यौगिक (B) देता है। यौगिक ‘B’ HBr के साथ अभिक्रिया से यौगिक ‘C’ देता है जो कि यौगिक ‘A’ का समावयवी है। जब यौगिक ‘A’ की अभिक्रिया सोडियम धातु से होती है तो यौगिक ‘D’ C8H18 बनाता है, जो कि ब्यूटिलब्रोमाइड की सोडियम से अभिक्रिया द्वारा बने उत्पाद से भिन्न है।यौगिक ‘A’ का संरचना सूत्र दीजिए तथा सभी अभिक्रियाओं की समीकरण दीजिए।
उत्तर
दिये गये C4H9Br 1° एल्किल हैलाइड के संभावित दो समावयवी है।

प्रश्नानुसार यौगिक A सोडियम के साथ क्रिया द्वारा समान उत्पाद नहीं बनाता है। जो n-ब्यूटिलब्रोमाइड बनाता है। इसलिये A(I) नहीं होगा।
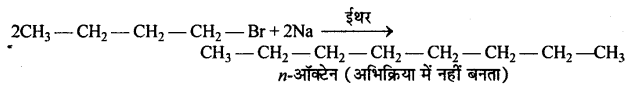
अतः (II) सही समावयवी होगा।
सम्पूर्ण अभिक्रिया के लिये समीकरण होगा –
प्रश्न 22.
तब क्या होता है, जब
(i) n-ब्यूटिलक्लोराइड को ऐल्कोहॉलिक KOH के साथ अभिकृत किया जाता है ?
(ii) शुष्क ईथर की उपस्थिति में ब्रोमोबेंजीन की अभिक्रिया मैग्नीशियम से होती है ?
(iii) क्लोरोबेन्जीन का जल-अपघटन किया जाता है ?
(iv) एथिलक्लोराइड की अभिक्रिया जलीय KOH से होती है ?
(v)शुष्क ईथर की उपस्थिति में मेथिलब्रोमाइड की अभिक्रिया सोडियम से होती है ?
(vi) मेथिलक्लोराइड की अभिक्रिया KCN से होती है ?
गर्म
उत्तर
(i)

(ii)
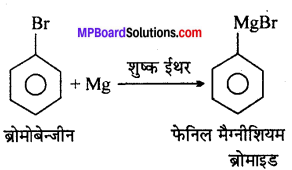
![]()
(ii)
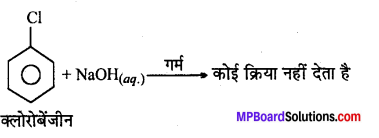
(iv)

(v)

(vi)
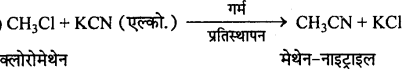
हैलोऐल्केन तथा हैलोऐरीन अन्य महत्वपूर्ण प्रश्नोत्तर
हैलोऐल्केन तथा हैलोऐरीन वस्तुनिष्ठ प्रश्न
1. सही विकल्प चुनकर लिखिए –
प्रश्न 1.
निम्न में से कौन-सा यौगिक AgNO, विलयन के साथ पीला अवक्षेप देगा-
(a) KIO3
(b) CHI3
(c) KI
(d) CH2I2.
उत्तर
(c) KI
प्रश्न 2.
एथिल ब्रोमाइड की लेड सोडियम मिश्र धातु के साथ क्रिया करने पर बनता है –
(a) टेट्राएथिल लेड
(b) टेट्रा एथिल ब्रोमाइड
(c) दोनों
(d) कोई नहीं।
उत्तर
(a) टेट्राएथिल लेड
प्रश्न 3.
अभिक्रिया CH3Br + OH– → CH3 – OH + Br– है –
(a) इलेक्ट्रॉन स्नेही प्रतिस्थापन
(b) इलेक्ट्रॉनस्नेही योग
(c) नाभिकस्नेही योग
(d) नाभिकस्नेही प्रतिस्थापन ।
उत्तर
(d) नाभिकस्नेही प्रतिस्थापन ।
![]()
प्रश्न 4.
जब एसीटिलीन HCI के साथ योग करता है तो बनने वाला उत्पाद है –
(a) CH2 = CH – Cl
(b) CH3 – CH – C2.
(c) Cl – CH = CH – Cl
(d) कोई नहीं।
उत्तर
(b) CH3 – CH – C2.
प्रश्न 5.
ऐरिल हैलाइड में हैलोजन परमाणु से जुड़ा कार्बन होता है –
(a) sp संकरित
(b) sp2 संकरित
(c) sp3 संकरित
(d) sp3d संकरित।
उत्तर
(b) sp2 संकरित
प्रश्न 6.
SN1 प्रक्रिया में प्रथम पद में निर्माण होता है –
(a) मुक्त मूलक का
(b) कार्ब ऐनायन
(c) कार्ब धनायन
(d) अंतिम उत्पाद।
उत्तर
(c) कार्ब धनायन
प्रश्न 7.
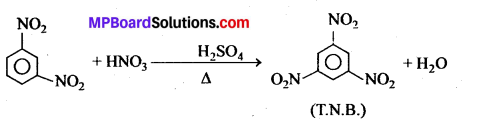
क्लोरो बेंजीन, SN2 क्लोरल तथा सान्द्र H2SO4 के साथ क्रिया करके बनाता है
(a) P.V.C.
(b) T.N.T.
(c) B.H.U.
(d) D.D.T.
उत्तर
(d) D.D.T.
प्रश्न 8.
CH3OH + OH– → CH3.OH + Br– है –
(a) SN1
(b) SN2
(c) SE-1
(d) SE-2
उत्तर
(b) SN2
![]()
प्रश्न 9.
निम्न यौगिक रजत चूर्ण के साथ गर्म करने पर ऐसीटिलीन देता है
(a) CH2I2
(b) CH3I
(c) CHI3
(d) Cl4
उत्तर
(c) CHI3
प्रश्न 10.
आग बुझाने के लिए पायरीन का उपयोग निम्न में से किसी एक के द्वारा होता है –
(a) CO2
(b) CH2Cl2
(c) CCl4
(d) CH2 = CHCl.
उत्तर
(c) CCl4
प्रश्न 11.
निम्न में से कौन-सा यौगिक फ्रिऑन के नाम से जाना जाता है –
(a) CHCl3
(b) CCl4
(c) CCl2F2
(d) CF4
उत्तर
(c) CCl2F2
प्रश्न 12.
एथिल आयोडाइड को ऐल्कोहॉलीय KOH के साथ गर्म करने पर प्राप्त होगा –
(a) एथेनॉल
(b) एथेन
(c) एसीटिलीन
(d) एथिलीन।
उत्तर
(d) एथिलीन।
प्रश्न 13.
C2H5-OH को आयोडीन और क्षार के साथ गर्म करने पर बनता है –
(a) CH3I
(b) CHI3
(c) CH3 – CHO
(d) CHCl3.
उत्तर
(b) CHI3
प्रश्न 14.
निम्न में से कौन-सा रासायनिक सूत्र क्लोरो पिक्रिन का है –
(a) CCl3 – CHO
(b) C(NO2)Cl3
(c) CH3-C(NO2)Cl2
(d) CCl3-NH2
उत्तर
(b) C(NO2)Cl3
प्रश्न 15.
CH,I, CH,Br तथा CHICI अणुओं की ध्रुवता का क्रम है –
(a) CH2Br > CH2Cl>CH3I
(b) CH3I > CH3Br > CH2Cl
(c) CH3Cl > CH3Br > CH3I
(d) CH3Cl > CH3I > CH3Br.
उत्तर
(c) CH3Cl > CH3Br > CH3I
प्रश्न 16.
ऐल्किल हैलाइडों की क्रियाशीलता का सही क्रम होगा –
(a) आयोडाइड > ब्रोमाइड > क्लोराइड
(b) आयोडाइड < ब्रोमाइड < क्लोराइड
(c) ब्रोमाइड > आयोडाइड > क्लोराइड
(d) ब्रोमाइड < क्लोराइड > आयोडाइड।
उत्तर
(a) आयोडाइड > ब्रोमाइड > क्लोराइड
![]()
प्रश्न 17.
आयोडोफॉर्म को सिल्वर चूर्ण के साथ गर्म करने पर बनता है –
(a) ऐल्केन
(b) एथिलीन
(c) एसीटिलीन
(d) आइसोसाइनाइड।
उत्तर
(c) एसीटिलीन
प्रश्न 18.
रेशिग विधि निम्न में से किसके निर्माण में प्रयुक्त होती हैं –
(a) क्लोरोबेंजीन
(b) बेंजीन
(c) टालुईन
(d) नाइट्रो बेंजीन।
उत्तर
(a) क्लोरोबेंजीन
2. रिक्त स्थानों की पूर्ति कीजिए –
- क्लोरोफॉर्म को खुला छोड़ने पर बनने वाला हानिकारक उत्पाद का सूत्र ………….. है।
- ऐल्किल हैलाइड का सामान्य सूत्र ……………… है।
- ऐरोमैटिक प्राथमिक एमीन को क्लोरोफॉर्म और ऐल्कोहॉलीय कॉस्टिक पोटॉश के साथ गर्म करने पर एक दुर्गन्ध युक्त गैस ……………… बनता है।
- B.H.C. एक कीटनाशी है, जिसका व्यापारिक नाम …………….. है।
- क्लोरीटोन उच्च कोटि की ……………… है।।
- SN1 अभिक्रिया ……………… पद में होती है।
- हैलो एरीन में प्रतिस्थापन अभिक्रियाएँ मुख्यतः……………… होती हैं।
- प्रशीतक फ्रिऑन का सूत्र ……………… है।
उत्तर
- COCl2
- CnH2n+1
- फेनिल आइसो सायनाइड
- गैमेक्सीन (या लिण्डेन)
- निद्राकारी औषधि
- दो,
- इलेक्ट्रॉनस्नेही
- CCl2F2.
![]()
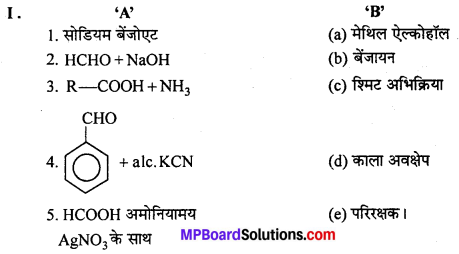
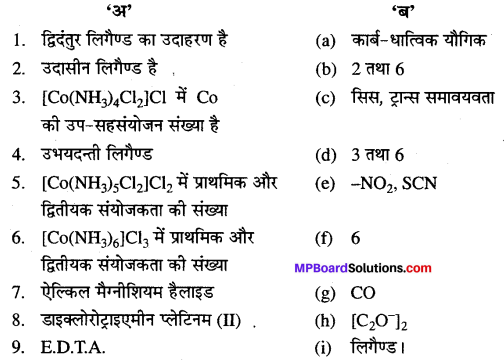
3. उचित सम्बन्ध जोडिए –

उत्तर
- (d)
- (e)
- (f)
- (b)
- (c)
- (g)
- (a).
4. एक शब्द / वाक्य में उत्तर दीजिए –
- बेंजीन को मेथिल क्लोराइड के साथ निर्जल AlCl3 की उपस्थिति में क्रिया करने पर टॉलुईन बनता है। इस अभिक्रिया का नाम क्या है ?
- ऐल्किल हैलाइड ध्रुवीय प्रकृति का होता है फिर भी जल में अविलेय है।
- ऐल्किल हैलाइड के सोडियम धातु के साथ गर्म करने पर बनता है।
- बेंजीन डाइएजोनियम लवण को क्युप्रस हैलाइड और उसके संगत अम्ल के साथ गर्म करने पर हैलो ऐरीन बनता है । इस अभिक्रिया का नाम लिखिए।
- आयोडो बेंजीन कॉपर चूर्ण के साथ 200°C पर गर्म करने पर प्राप्त होता है।
- बेंजीन को सूर्य प्रकाश की उपस्थिति में Cl2 के साथ क्रिया कराने पर बनता है।
- क्लोरोबेंजीन बनाने की प्रयोगशाला विधि का नाम लिखिए।
- प्राथमिक ऐल्किल हैलाइड में होने वाली नाभिकस्नेही प्रतिस्थापन अभिक्रिया की क्रिया-विधि का नाम लिखिए।
उत्तर
- फ्रीडल क्रॉफ्ट अभिक्रिया
- हाइड्रोजन बन्ध नहीं बनाने के कारण
- ऐल्केन
- सैण्डमेयर अभिक्रिया
- डाइफेनिल
- B.H.C.
- रेशिग विधि
- द्विअणुक नाभिकस्नेही प्रतिस्थापन अभिक्रिया।
हैलोऐल्केन तथा हैलोऐरीन लघु उत्तरीय प्रश्न
प्रश्न 1.
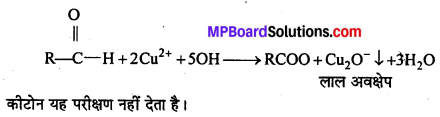
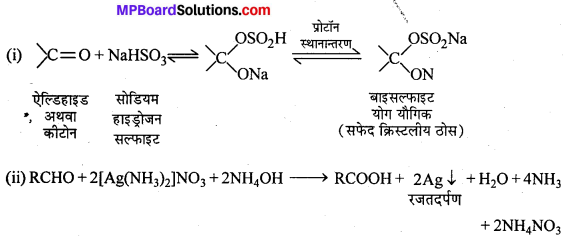
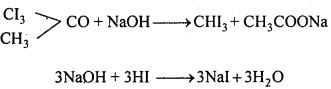
(i) आयोडोफॉर्म अभिक्रिया लिखिए।
(ii) AgNO3 विलयन के साथ CHI3 पीला अवक्षेप देता है जबकि क्लोरोफॉर्म नहीं देता, क्यों?
(iii) क्या होता है, जब ऐथिल ब्रोमाइड को ऐल्कोहॉलीय KOH के साथ गर्म किया जाता है ?
उत्तर
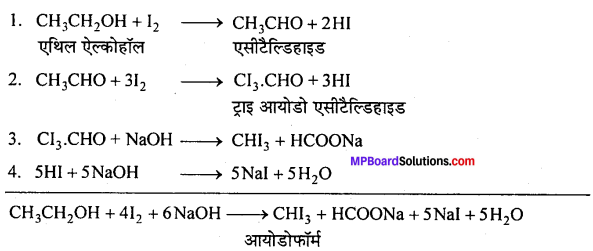
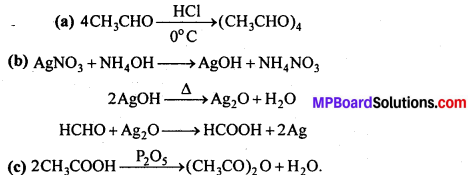
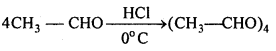
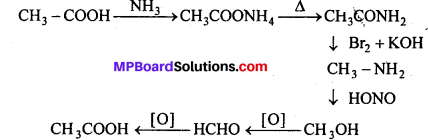
(i) एथिल ऐल्कोहॉल या ऐसीटोन को I2 और NaOH के साथ गर्म करने पर पीले रंग का क्रिस्टल बनता है। इसे आयोडोफॉर्म या हैलोफॉर्म अभिक्रिया कहते हैं।
C2H5OH + 4I2 + 6NaOH → 5Nal + HCOONa + 5H2O + CHI3
(ii) आयोडोफॉर्म में C-I बन्ध क्लोरोफॉर्म के C-Cl बन्ध की तुलना में कमजोर होता है। अतः CHI3, AgNO3 के साथ Agl का पीला अवक्षेप बनाता है, किन्तु CHCl3 अवक्षेप AgCl नहीं बनाता।
(iii) एथिल ब्रोमाइड को एल्कोहॉलीय KOH के साथ उबालने पर एथिलीन बनता है।
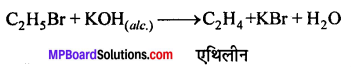
![]()
प्रश्न 2.
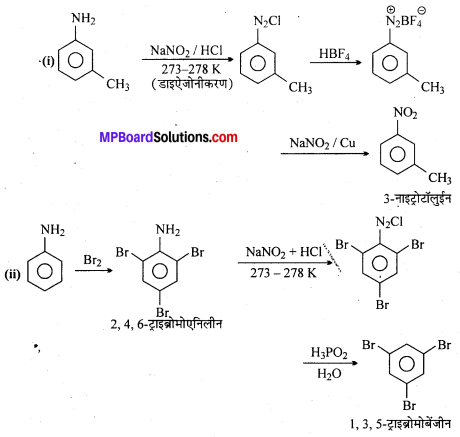
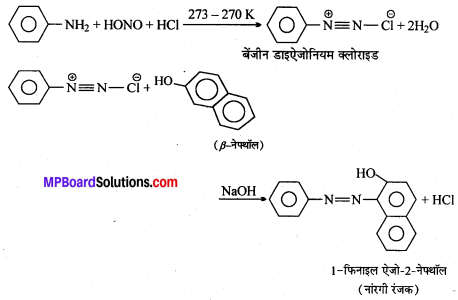
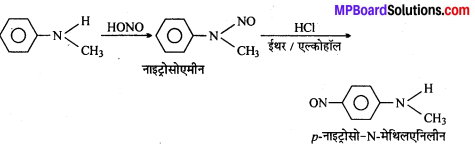
सैण्डमेयर अभिक्रिया को उदाहरण सहित समझाइए।
उत्तर
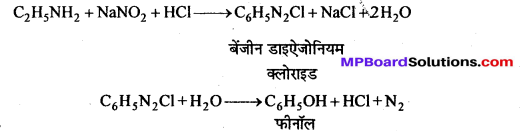
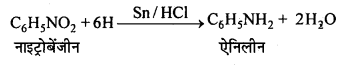
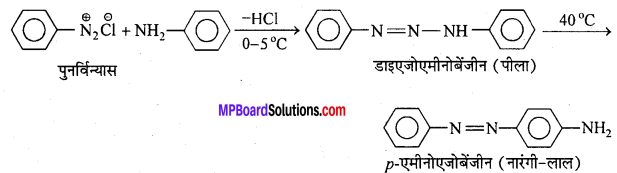
सैण्डमेयर अभिक्रिया-ऐरोमैटिक प्राथमिक ऐमीन को HNO2 के साथ 0°C से 5°C ताप पर अभिक्रिया कराने पर बेंजीन डाइऐजोनियम लवण बनता है जो क्यूप्रस और उसके संगत हैलोजन अम्ल की उपस्थिति में विघटित होकर हैलोएरीन देते हैं।
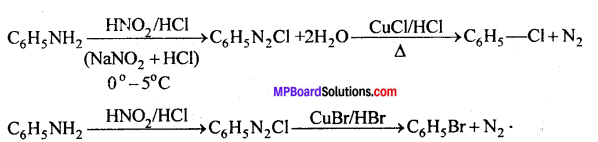
प्रश्न 3.
क्लोरोबेंजीन और क्लोरल की सान्द्र H2SO4 की उपस्थिति में होने वाली अभिक्रिया का समीकरण लिखिए।
अथवा, डी.डी.टी. कैसे बनता है ? इसका एक उपयोग लिखिए।
उत्तर
जब क्लोरल को सान्द्र H2SO4 की उपस्थिति में क्लोरोबेंजीन के साथ संघनित करते हैं, तो डी. डी. टी. अर्थात् डाइक्लोरो डाइफेनिल ट्राइक्लोरोएथेन बनता है।
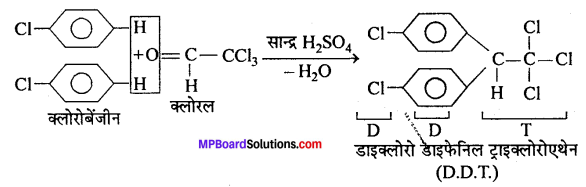
उपयोग-यह एक शक्तिशाली कीटनाशी है।
प्रश्न 4.
जैम-डाइहैलाइड और विस-डाइहैलाइड किसे कहते हैं ?
उत्तर
जब हाइड्रोकार्बन के एक ही कार्बन परमाणु पर दोनों हैलोजन परमाणु जुड़े हों तो उसे जैमडाइहैलाइड (Gem-Dihalide) कहते हैं। Gem mean geminal अर्थात् Same position.
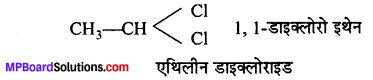
जब दो हैलोजन परमाणु निकटस्थ दो विभिन्न कार्बन परमाणुओं से जुड़े हों, तो उसे विस-डाइहैलाइड (Vis-dihalide) कहते हैं। Vis-means vicinal जिसका अर्थ है- Adjacent position.

प्रश्न 5.
ल्यूकॉस अभिकर्मक क्या है ? इसका क्या उपयोग है ?
उत्तर
ल्यूकॉस अभिकर्मक-जिंक क्लोराइड का सान्द्र HCl में विलयन ल्यूकॉस अभिकर्मक कहलाता है। उपयोग-इसका उपयोग प्राथमिक, द्वितीयक और तृतीयक ऐल्कोहॉलों में भेद करने के लिए किया जाता है।
ऐल्कोहॉल में ल्यूकॉस अभिकर्मक मिलाने पर यदि तत्काल (20-30 सेकेण्ड में) अवक्षेप या धुंधलापन प्राप्त हो तो वह तृतीयक ऐल्कोहॉल है। यदि लगभग 5 मिनट बाद अवक्षेप बने तो द्वितीयक ऐल्कोहॉल तथा यदि अवक्षेप बिल्कुल न बने तो प्राथमिक ऐल्कोहॉल है।
![]()
प्रश्न 6.
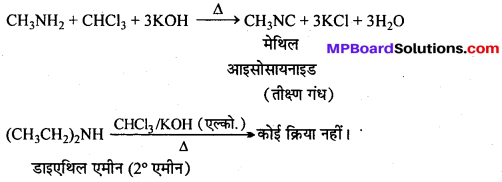
कार्बिल ऐमीन अभिक्रिया को समझाइए एवं उसका एक उपयोग लिखिए।
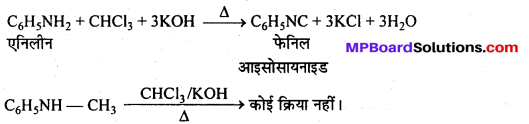
उत्तर
कार्बिल ऐमीन अभिक्रिया–ऐलिफैटिक या ऐरोमैटिक प्राथमिक ऐमीन को CHCl3 तथा ऐल्कोहॉलीय KOH के साथ गर्म करने से तीव्र दुर्गन्ध युक्त फेनिल आइसोसायनाइड (कार्बिल ऐमीन) बनता है। इसका उपयोग क्लोरोफॉर्म परीक्षण तथा प्राथमिक ऐमीन परीक्षण में किया जाता है।
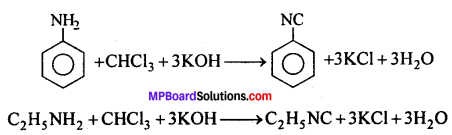
प्रश्न 7.
666 क्या है ? इसके बनाने की विधि दीजिए एवं कृषि में इसका उपयोग बताइये।
उत्तर
बेंजीन को Cl2 के साथ सूर्य प्रकाश की उपस्थिति में क्रिया कराने पर B.H.C. बनता है। इसे 666 – या गैमेक्सेन या लिण्डेन या 1, 2, 3, 4, 5, 6, हेक्साक्लोरो साइक्लोहेक्सेन भी कहते हैं।
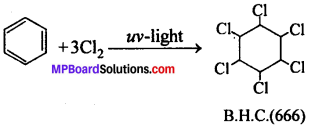
उपयोग-यह कृषि में कीटनाशी के रूप में उपयोगी है।
प्रश्न 8.
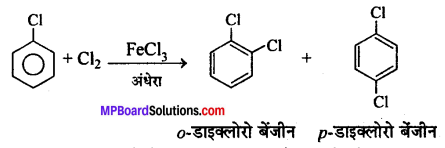
क्लोरोबेंजीन की निम्न अभिक्रियाओं को समझाइए(a) अंधेरे में FeCl3 की उपस्थिति में क्लोरीन के साथ अभिक्रिया। (b) फिटिग अभिक्रिया।
उत्तर
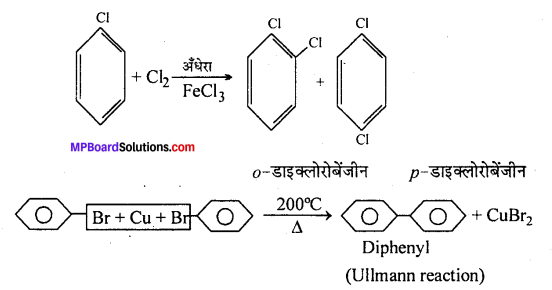
(a) क्लोरोबेंजीन, क्लोरीन से FeCl3 की उपस्थिति में अंधेरे से क्रिया करके o-डाइक्लोरो बेंजीन तथा p-डाइक्लोरो बेंजीन बनाता है।
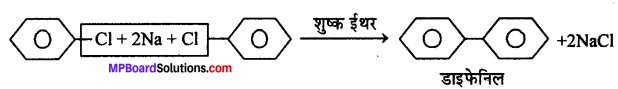
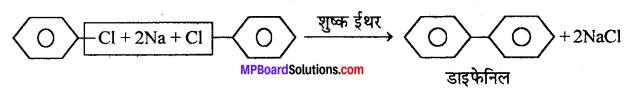
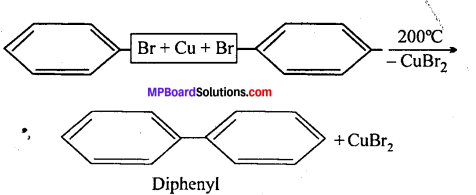
(b) फिटिग (Fittig) अभिक्रिया- जब एरिल हैलाइड के दो अणु Na धातु के साथ शुष्क ईथर की उपस्थिति में क्रिया करते हैं तो डाइफेनिल बनाते हैं, इसे फिटिग अभिक्रिया कहते हैं।
प्रश्न 9.
क्लोरोफॉर्म से निम्नलिखित को आप किस प्रकार प्राप्त करेंगे, समीकरण लिखिए –
(a) मेथेन, (b) ऐसीटिलीन, (c) कार्बन टेट्राक्लोराइड।
उत्तर
(a) Zn और H2O द्वारा अपचयन से मेथेन बनता है।
![]()
(b) क्लोरोफॉर्म को रजत चूर्ण के साथ गर्म करने पर ऐसीटिलीन बनता है।
![]()
(c) क्लोरोफॉर्म सूर्य के प्रकाश में क्लोरोनीकृत होकर CCIA बनाता है।
![]()
प्रश्न 10.
टिप्पणी लिखिए –
(a) हुन्सडीकर विधि, (b) रेशिग प्रक्रम।
उत्तर
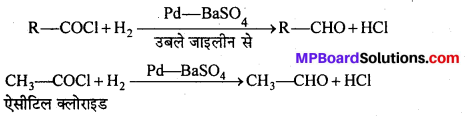
(a) हुन्सडीकर विधि-ऐरोमैटिक कार्बोक्सिलिक अम्ल के सिल्वर लवण को ब्रोमीन के साथ गर्म करने से ऐरिल ब्रोमाइड बनता है।
![]()
(b) रेशिग विधि (औद्योगिक विधि)-बेंजीन वाष्प, वायु एवं HCl गैस मिश्रण को 503K ताप पर उत्प्रेरक CuCl2 पर से प्रभावित करके क्लोरोबेंजीन बनाया जाता है।
![]()
प्रश्न 11.
फ्रीऑन बनाने की विधि, गुण एवं उपयोग दीजिए।
उत्तर
डाईक्लोरो डाईफ्लुओरो मेथेन, SbCls की उपस्थिति में CCl4 एवं SbF3 की अभिक्रिया से फ्रीऑन बनता है।
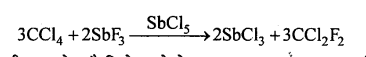
इसका क्वथनांक काफी कम होता है जिसे कमरे के ताप पर दाब बढ़ाकर आसानी से द्रवित कर लिया जाता है।
उपयोग – यह एक विषैला, अज्वलनशील तथा अक्रिय पदार्थ है जो रेफ्रिजरेटर में कूलिंग एजेन्ट के रूप में उपयोग किया जाता है। यह एरोसॉल व फोम में नोदक के रूप में भी प्रयुक्त किया जाता है।
प्रश्न 12.
(i) एथिल आयोडाइड का क्वथनांक एथिल ब्रोमाइड से अधिक होता है। कारण लिखिए।
(i) क्या कारण है कि पैराडाइक्लोरो बेंजीन का गलनांक ऑर्थो एवं मेटा समावयवियों से अधिक होता है ?
उत्तर
(i) समान ऐल्किल समूह वाले ऐल्किल हैलाइडों के क्वथनांक उनमें उपस्थित हैलोजन परमाणु के परमाणु भार में वृद्धि के साथ बढ़ते हैं। एथिल आयोडाइड का अणुभार एथिल ब्रोमाइड से अधिक होता है इसलिए एथिल आयोडाइड का क्वथनांक अधिक होता है।
(ii) डाइक्लोरो बेंजीन का पैरा समावयवी ऑर्थो एवं मेटा समावयवियों की तुलना में अधिक सममित होता है तथा क्रिस्टल लैटिस में अच्छी तरह व्यवस्थित होता है, इस कारण पैरा डाइक्लोरोबेंजीन का गलनांक ऑर्थो एवं मेटा समावयवियों से अधिक होता है।
![]()
प्रश्न 13.
ऐल्किल हैलाइडों के प्रमुख न्यूक्लियोफिलिक प्रतिस्थापन अभिक्रियाएँ दीजिए।
उत्तर
न्यूक्लियोफिलिक प्रतिस्थापन अभिक्रियाएँ – (i) जल-अपघटन – OH समूह द्वारा प्रतिस्थापन-ऐल्किल हैलाइड HCI को जल या जलीय KOH के साथ जल-अपघटन कराने पर ऐल्कोहॉल बनता है।
C2H5Br + KOH → C2H5OH + KBr
(ii) -OR समूह द्वारा विस्थापन (ईथर का बनना)-ऐल्किल हैलाइड, सोडियम एल्कॉक्साइड (NaOR) या Ag2O के साथ क्रिया करके हैलोजन परमाणु को-OR समूह द्वारा विस्थापित करके ईथर बनाते हैं।
C2H5Br + NaOC2H5 → (C2H5OC2H5 + NaBr)
2C2H5I + Ag2O → (C2H5)2O + 2AgI
(iii)-CN समूह द्वारा प्रतिस्थापन-ऐल्किल हैलाइड जलीय या एल्कोहॉलीय KCN से क्रिया करके ऐल्किल सायनाइड बनाते हैं।
C2H5Cl + KCN → C2H5CN + KCl
(iv) अभिक्रिया के साथ क्रिया (हॉफमैन विधि)-एल्किल हैलाइड को NH3 के जलीय या ऐल्कोहॉलीय विलयन के साथ बंद नली में 100°C पर गर्म करने पर विभिन्न ऐमीन का मिश्रण प्राप्त होता है। .
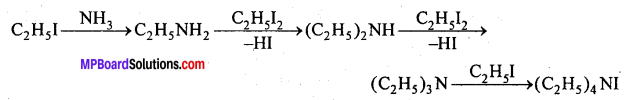
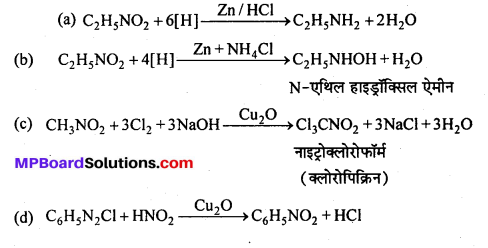
प्रश्न 14.
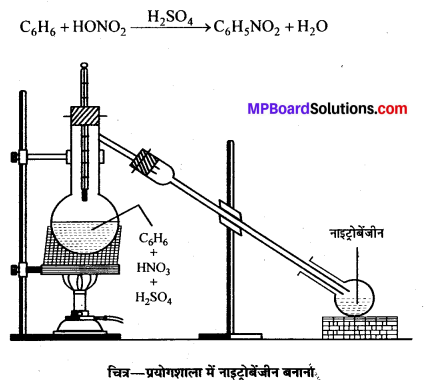
प्रयोगशाला में क्लोरोबेंजीन बनाने की विधि का समीकरण लिखिए तथा इसकी नाइट्रीकरण और सल्फोनीकरण क्रियाएँ लिखिए।
उत्तर
प्रयोगशाला में लौह चूर्ण या आयोडीन की उपस्थिति में गर्म बेंजीन विलयन में शुष्क क्लोरीन प्रवाहित करके क्लोरोबेंजीन प्राप्त किया जाता है।
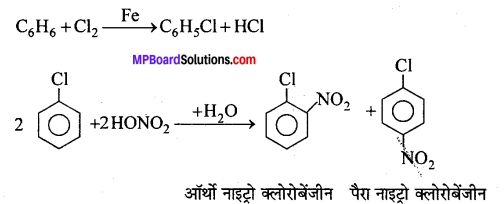
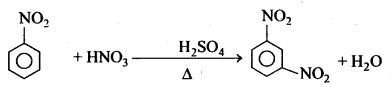
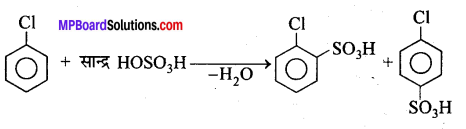
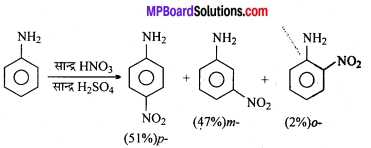
नाइट्रीकरण क्रिया – क्लोरोबेंजीन सान्द्र नाइट्रिक अम्ल के साथ सान्द्र H2SO4 की उपस्थिति में गर्म करने पर ऑर्थो तथा पैरा नाइट्रोक्लोरोबेंजीन का मिश्रण बनाता है।
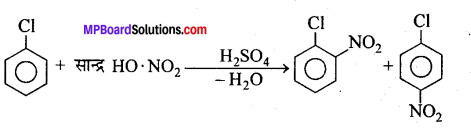
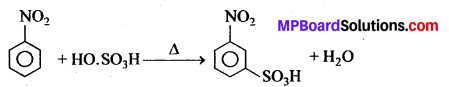
सल्फोनीकरण क्रिया – सान्द्र H2SO4 के साथ क्लोरोबेंजीन को गर्म करने पर ऑर्थो तथा पैरा क्लोरोबेंजीन सल्फोनिक अम्लों का मिश्रण प्राप्त होता है।
प्रश्न 15.
एथिल आयोडाइड की निम्न के साथ होने वाली अभिक्रिया का रासायनिक समीकरण दीजिए
(1) Pb-Na मिश्रधातु
(2) Mg धातु
(3) AgNO2
(4) सोडियम धातु के साथ।
उत्तर
(1) Pb – Na मिश्रधातु के साथ-एथिल आयोडाइड Pb – Na मिश्र धातु के साथ क्रिया करके T.E.L. बनाते हैं।
4C2H5I + 4Pb / Na→(C2H5)4 Pb+3Pb+4NaI
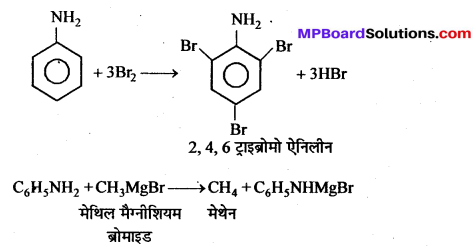
(2) Mg धातु के साथ-एथिल आयोडाइड शुष्क ईथर विलायक की उपस्थिति में Mg धातु से क्रिया करके ग्रिगनार्ड अभिकर्मक बनाता है।
![]()
(3) AgNO2 के साथ-नाइट्रो एथेन मुख्य रूप से बनता है।
C2H5I + AgNO2 → C2H5NO2 + AgI
(4) सोडियम धातु के साथ-एथिल आयोडाइड को Na धातु के साथ ईथर की उपस्थिति में गर्म करते हैं तो ब्यूटेन बनता है।
![]()
प्रश्न 16.
डाइ-क्लोरो एथेन के बनाने की विधि लिखिए। इसके मुख्य गुण तथा उपयोग बताइए।
उत्तर-डाइ-क्लोरोएथेन बनाने की विधि-एथेन के दो H-परमाणुओं को दो हैलोजन परमाणुओं से विस्थापित कराते हैं तो डाइ-क्लोरो एथेन प्राप्त होता है।
(1) एथीन-एथिलीन वाष्प या द्रव में CCl4 में विलेय की हुई क्लोरीन गैस प्रवाहित करने पर 1, 2 डाइ क्लोरो एथेन बनता है।
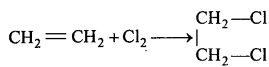
(2) ग्लाइकॉल-एथेन डाइ-ऑल और HCl अम्ल के मिश्रण को निर्जल ZnCl, की उपस्थिति में पश्चवाहन करने पर 1, 2 डाइ-क्लोरो एथेन बनता है।
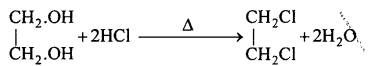
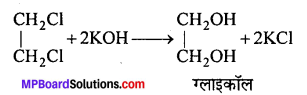
गुण-(1) जलीय KOH के साथ –
(2) ऐल्कोहॉलीय पोटैशियम हाइड्रॉक्साइड के साथ-गर्म करने पर पहले वाइनिल क्लोराइड और अन्त में अल्प मात्रा में एथाइन बनता है। .
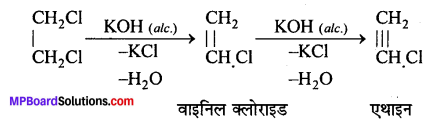
इस अभिक्रिया में बनने वाला मुख्य यौगिक वाइनिल एथिल ईथर है। यह वाइनिल क्लोराइड से ऐल्को.. कॉस्टिक पोटॉश की अभिक्रिया से बनता है।
CH2= CHCl + HOC2 → H5 + KOHCH2 == CH – O – C2H5 + KCl + H2O
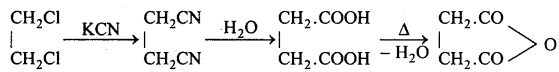
(3) KCN के साथ-पहले डाइसायनो एथेन बनाता है, जिसके जल-अपघटन से सक्सिनिक अम्ल बनाता है, जिसे गर्म करके सक्सिनिक ऐनहाइड्राइड मिलता है।
(4) जिंक चूर्ण और मेथेनॉल के साथ-जिंक चूर्ण और मेथेनॉल के साथ गर्म करने पर एथिलीन बनता है।
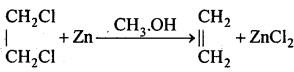
उपयोग-(1) विलायक के रूप में, (2) अपस्फोटरोधी ईंधन के अवयव के रूप में, (3) पेण्ट को हटाने में।
![]()
प्रश्न 17.
फ्रेंकलैण्ड अभिक्रिया को लिखिए।
उत्तर
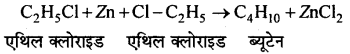
प्रश्न 18.
फ्रीडल-क्रॉफ्ट्स एवं एसिलीकरण अभिक्रिया को समीकरण सहित समझाइए।
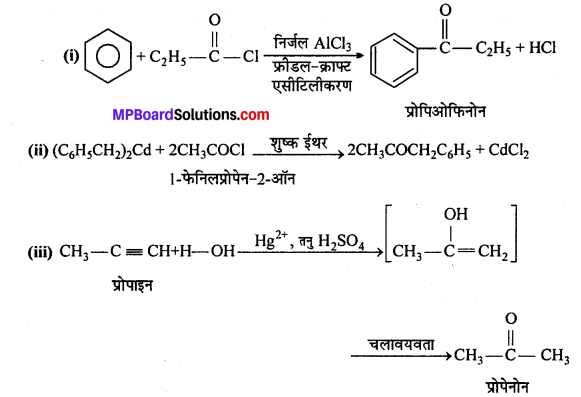
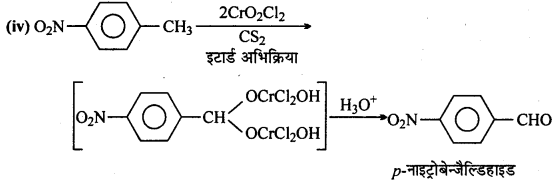
उत्तर
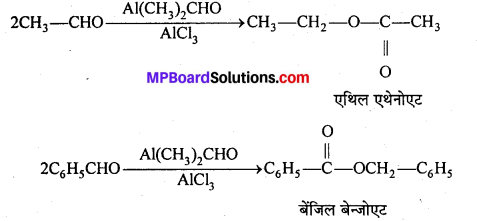
फ्रीडल-क्रॉफ्ट्स अभिक्रिया-जब ऐल्किल हैलाइड की अभिक्रिया बेंजीन के साथ निर्जल ऐल्युमिनियम क्लोराइड की उपस्थिति में कराई जाती है तो ऐल्किल बेंजीन प्राप्त होता है।
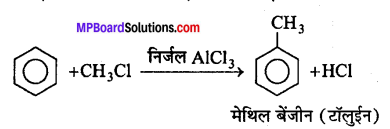
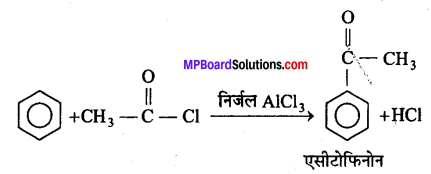
एसिलीकरण अभिक्रिया-जब एसीटिल क्लोराइड की अभिक्रिया बेंजीन के साथ निर्जल AICl3, की उपस्थिति में कराते हैं, तो एसीटोफिनोन प्राप्त होता है।
प्रश्न 19.
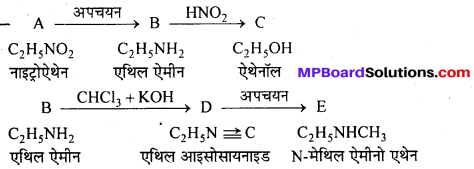
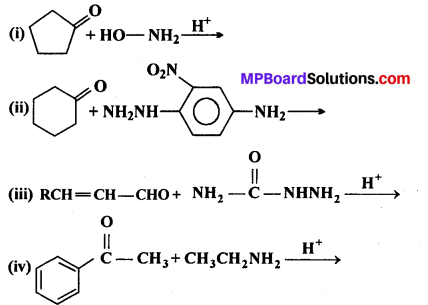
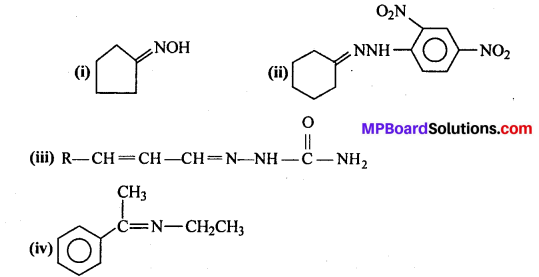
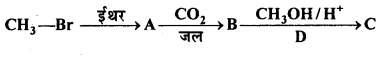
निम्न अभिक्रिया में A, B, C, D पहचानिए –
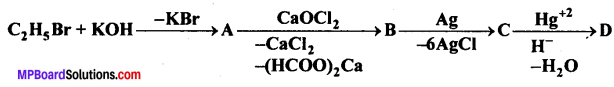
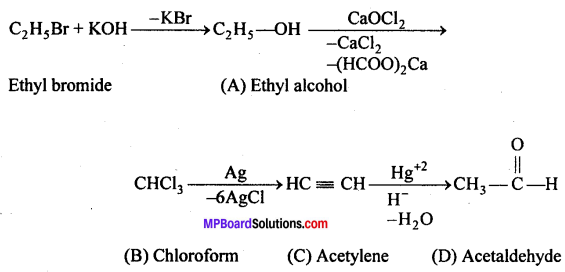
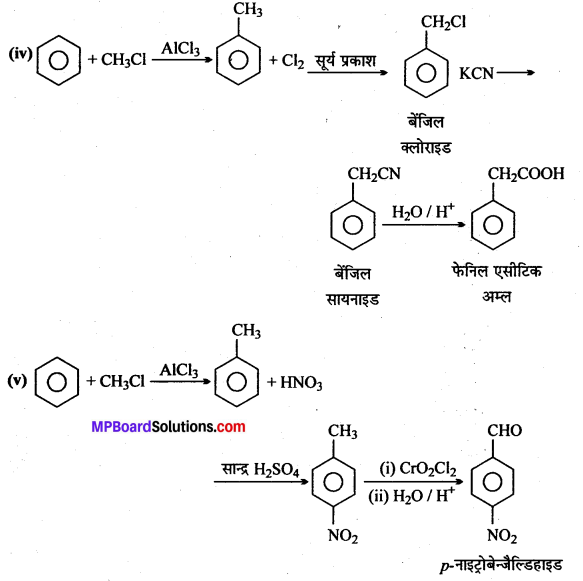
उत्तर
प्रश्न 20.
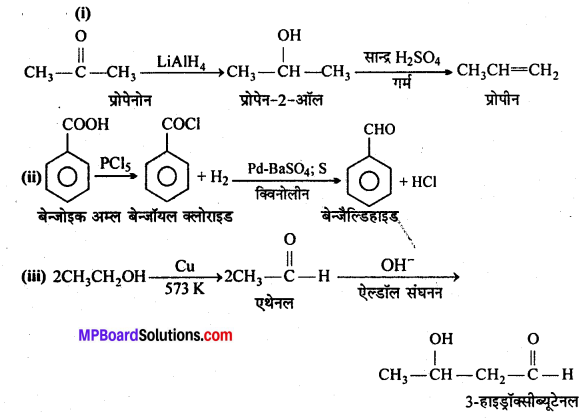
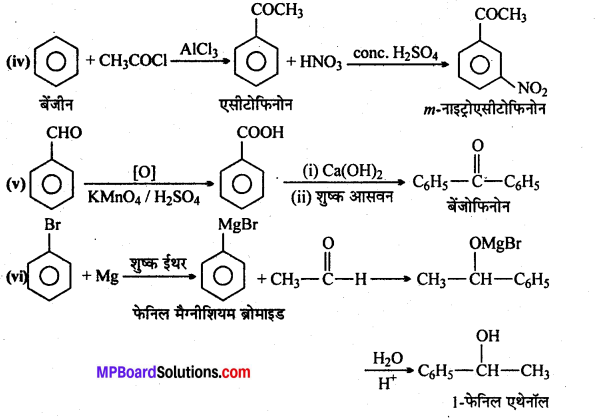
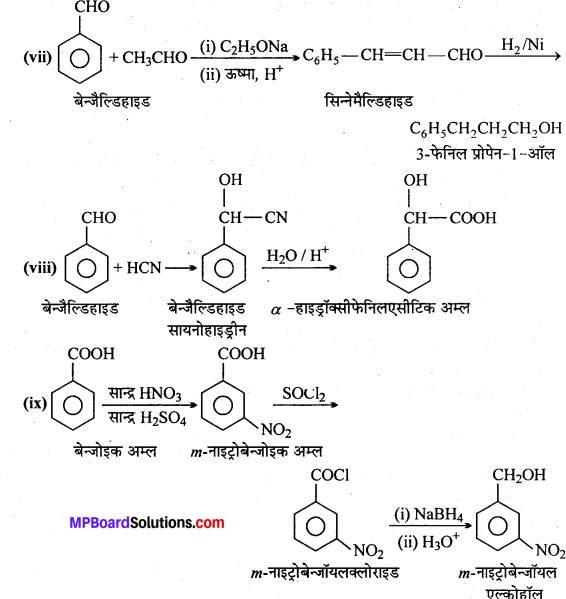
एक ऐल्कोहॉल A सान्द्र H2SO4 के साथ गर्म करने पर ऐल्कीन B देता है।B को ब्रोमीन जल मे प्रवाहित करने पर प्राप्त यौगिक का सोडामाइड की अधिकता द्वारा विहाइड्रोजनीकरण करने पर एक नया यौगिक C बनता है। “C” HgSO4 की उपस्थिति मे H2SO2 से क्रिया कर यौगिक D देता है। A, B, C, D यौगिक पहचानिए।
उत्तर
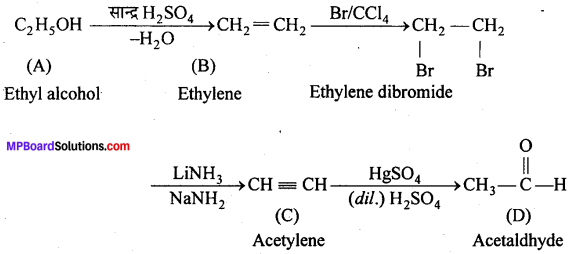
हैलोऐल्केन तथा हैलोऐरीन दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
टिप्पणी लिखिए
(a) हुन्सडीकर विधि, (b) रेशिग प्रक्रम, (c) कार्बिल-ऐमीन परीक्षण, (d) वेस्ट्रॉन, (e) आयोडोफॉर्म परीक्षण, (f) वु परीक्षण, (g) फ्रेंकलैंड अभिक्रिया, (h) फिटिग अभिक्रिया।
उत्तर
(a) हुन्सडीकर विधि-ऐरोमैटिक कार्बोक्सिलिक अम्ल के सिल्वर लवण को ब्रोमीन के साथ गर्म करने से ऐरिल ब्रोमाइड बनता है।
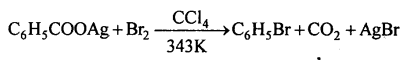
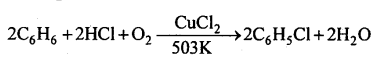
(b) रेशिग (Raschig) विधि (औद्योगिक विधि)-बेंजीन वाष्प, वायु एवं HCl गैस मिश्रण को 503K ताफै पर उत्प्रेरक CuCl2 पर से प्रभावित करके क्लोरोबेंजीन बनाया जाता है।
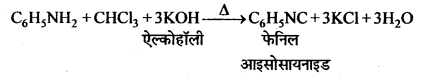
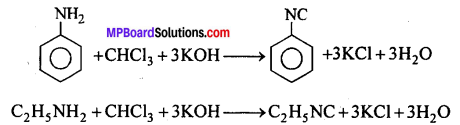
(c) कार्बिल-ऐमीन अभिक्रिया-ऐलिफैटिक या ऐरोमैटिक प्राथमिक ऐमीन को CHCl3 तथा ऐल्कोहॉलीय KOH के साथ गर्म करने से तीव्र दुर्गन्ध युक्त फेनिल आइसोसायनाइड (कार्बिल ऐमीन) बनता है। इसका उपयोग क्लोरोफॉर्म परीक्षण तथा प्राथमिक ऐमीन परीक्षण में किया जाता है।
(d) वेस्ट्रॉन-सममित टेट्राक्लोरो मेथेन या ऐसीटिलीन टेट्राक्लोराइड (CHCl2—CHCl2) को वेस्ट्रॉन कहते हैं। जिसे ऐसीटिलीन के क्लोरीनीकरण द्वारा बनाया जाता है।
CH ≡ CH + 2Cl2 → CHCl2-CHCl2
यह एक विषैला एवं अज्वलनशील द्रव है, चूने के साथ उबालने पर यह वेस्ट्रॉल बनाता है।
(e) आयोडोफॉर्म-लघु उत्तरीय प्रश्न क्र. 1(i) देखिए।
(f) वु परीक्षण-जब ऐल्किल हैलाइड को सोडियम के साथ शुष्क ईथर की उपस्थिति में गर्म करते हैं तो ऐल्केन बनता है।

(g) फ्रेंकलैंड अभिक्रिया-जब ऐल्किल हैलाइड को जिंक चूर्ण के साथ गर्म करते हैं तो ऐल्केन बनता है।
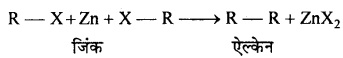
(h) फिटिग (Fittig) अभिक्रिया- जब ऐरिल हैलाइड के दो अणु Na धातु के साथ शुष्क ईथर की उपस्थिति में क्रिया करते हैं तो डाइफेनिल बनाते हैं, इसे फिटिग अभिक्रिया कहते हैं।
![]()
प्रश्न 2.
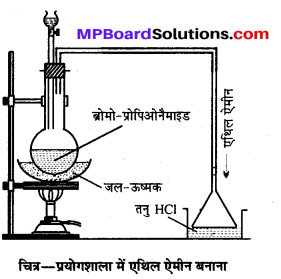
प्रयोगशाला में क्लोरोफॉर्म किस प्रकार बनाते हैं ? ऐथेनॉल से क्लोरोफॉर्म बनाने की विधि, सिद्धान्त, समीकरण, नामांकित चित्र एवं उपयोग के आधार पर समझाइए।
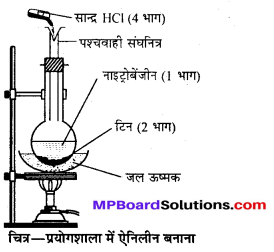
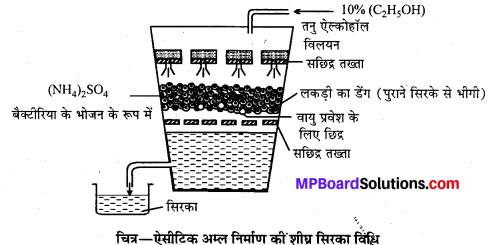
उत्तर
क्लोरोफॉर्म (CHCl3)-बनाने की प्रयोगशाला विधि-प्रयोगशाला में क्लोरोफॉर्म एथिल ऐल्कोहॉल अथवा ऐसीटोन को विरंजक चूर्ण (Bleaching powder) और जल के साथ अथवा क्लोरीन और NaOH के साथ गर्म करके बनाया जाता है। अभिक्रियाएँ निम्न पदों में होती हैं
सिद्धान्त-(i) विरंजक चूर्ण पर जल की क्रिया से आवश्यक क्लोरीन तथा कैल्सियम हाइड्रॉक्साइड बनता है।
CaOCl2 + H2O → Ca(OH)2 + Cl2
(ii) क्लोरीन ऑक्सीकारक एवं क्लोरीनीकारक दोनों की ही भाँति कार्य करती है। पहले ऐल्कोहॉल का । ऑक्सीकरण होता है फिर क्लोरीनीकरण होता है।
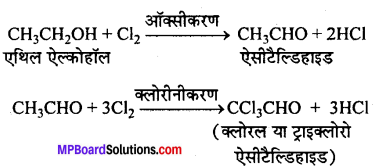
(iii) प्रथम पद में बना हुआ कैल्सियम हाइड्रॉक्साइड, क्लोरल का जल-अपघटन करके क्लोरोफॉर्म बनाता है।
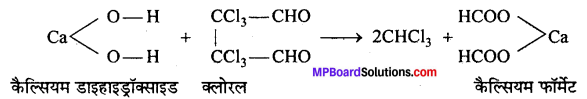
एथिल ऐल्कोहॉल के स्थान पर ऐसीटोन प्रयुक्त करने पर पहले ट्राइक्लोरोऐसीटोन बनता है जो चूने के पानी (कैल्सियम हाइड्रॉक्साइड) से जल-अपघटित होकर क्लोरोफॉर्म बनाता है।
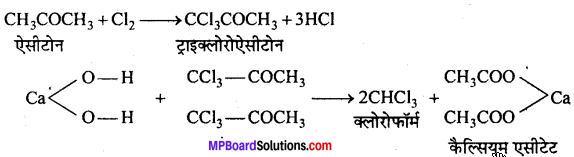
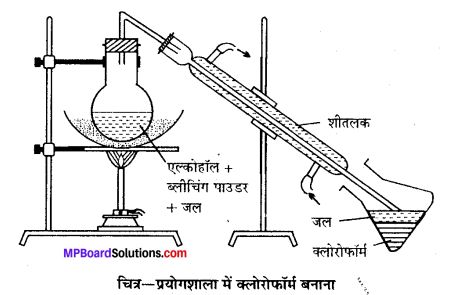
विधि-प्रयोगशाला में क्लोरोफॉर्म बनाने के लिए एक गोल पेंदी वाले फ्लास्क में 100 g विरंजक चूर्ण तथा 200 ml जल से बनी पेस्ट लेते हैं। इसमें 35 ml ऐथेनॉल अथवा ऐसीटोन डालकर चित्रानुसार उपकरण जमाते हैं।
फ्लास्क को बालू ऊष्मक (Sand bath) पर रखकर धीरे-धीरे गर्म करने पर क्लोरोफॉर्म बनता है जो आसवित होकर ग्राहक पात्र में भरे जल के नीचे बैठ जाता है। इस प्रकार प्राप्त क्लोरोफॉर्म को पृथक् करने से पहले कॉस्टिक सोडा के तनु विलयन से धोते हैं फिर कैल्सियम क्लोराइड द्वारा सुखाकर आसवन करते हैं जिससे शुद्ध क्लोरोफॉर्म प्राप्त होता है।
शुद्ध क्लोरोफॉर्म, क्लोरल हाइड्रेट और सोडियम हाइड्रॉक्साइड के सान्द्र विलयन को गर्म करके बनाया जाता है।
![]()
![]()
प्रश्न 3.
क्लोरोफॉर्म के अपचयन से क्या बनता है ? इसकी नाइट्रिक अम्ल तथा ऐसीटोन से क्रिया के समीकरण लिखिए।
उत्तर
क्लोरोफॉर्म का अपचयन-(a) Zn और HCl के साथ गर्म करने से यह अपचयित होकर मेथिलीन क्लोराइड बनता है।
![]()
(b) जिंक चूर्ण व जल के साथ गर्म करने पर मेथेन बनता है।
![]()
क्लोरोफॉर्म की क्रिया
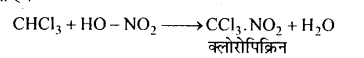
(a) सान्द्र HNO, से क्रिया-नाइट्रोक्लोरोफॉर्म (या क्लोरोपिक्रिन) बनाता है, जिसे युद्ध में विषैली गैस के रूप में प्रयोग किया जाता है।
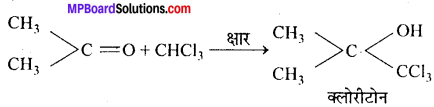
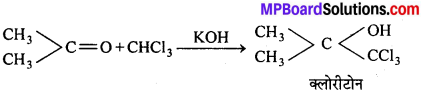
(b) ऐसीटोन से क्रिया-क्षार की उपस्थिति में ऐसीटोन के साथ संघनित होकर एक तीव्र निद्राकारी क्लोरीटोन बनाता है।
प्रश्न 4.
क्लोरोफॉर्म की निम्नलिखित क्रियाएँ समीकरण सहित समझाइए
(a) ऑक्सीकरण, (b) कार्बिल-ऐमीन अभिक्रिया, (c) रजत चूर्ण के साथ (d) नाइट्रीकरण, (e) राइमर-टीमैन अभिक्रिया।
अथवा
क्लोरोफॉर्म से आप निम्नलिखित कैसे प्राप्त करेंगे(a) कार्बोनिल क्लोराइड, (b) ऐसीटिलीन, (c) क्लोरोपिक्रिन, (d) फेनिल आइसो सायनाइड।
अथवा
ट्राइक्लोरो मेथेन निम्नलिखित से किस तरह क्रिया करता है
(a) वायु में खुला छोड़ने पर, (b) ऐनिलीन एवं एल्कोहॉली कॉस्टिक पोटाश, (c) रजत चूर्ण के साथ, (d) सान्द्र नाइट्रिक अम्ल के साथ, (e) फीनॉल के साथ।
उत्तर
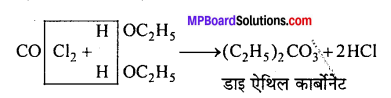
(a) ऑक्सीकरण (Oxidation)- वायु में खुला छोड़ने पर ऑक्सीकृत होकर विषैली गैस फॉस्जीन (कार्बोनिल) क्लोराइड बनाता है।
![]()
फॉस्जीन अति विषैली गैस है, अतः निश्चेतक कार्यों के लिए काम में आने वाले क्लोरोफॉर्म को फॉस्जीन से मुक्त होना चाहिए अर्थात् क्लोरोफॉर्म के उक्त प्रकार के ऑक्सीकरण को रोकना आवश्यक है। इसलिए क्लोरोफॉर्म को नीले या गहरे-भूरे रंग की बोतलों में मुँह तक भरकर रखा जाता है जिससे सक्रिय प्रकाश न पहुँचे
और वायु के लिए स्थान भी न बचे। साथ ही इसमें थोड़ा सा ऐथिल ऐल्कोहॉल भी मिला दिया जाता है यदि अल्प मात्रा में फॉस्जीन बन भी गई हो तो अविषैले ऐथिल कार्बोनेट में बदला जा सके।
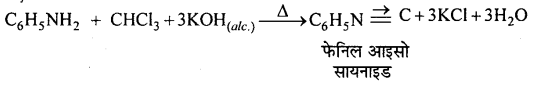
(b) कार्बिल-ऐमीन अभिक्रिया-क्लोरोफॉर्म को प्राथमिक ऐमीन (जैसे ऐनिलीन) तथा ऐल्कोहॉली कॉस्टिक पोटाश के साथ गर्म करने पर एक तीव्र दुर्गन्ध युक्त विषैला पदार्थ फेनिल आइसो सायनाइड बनता है। इसे कार्बिलऐमीन अभिक्रिया कहते हैं ।
(c) रजत चूर्ण के साथ (विहैलोजनीकरण)-क्लोरोफॉर्म को रजत चूर्ण के साथ उच्च ताप पर गर्म करने पर शुद्ध ऐसीटिलीन गैस बनती है।
![]()
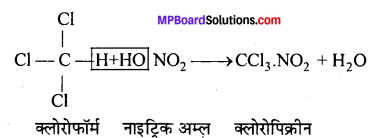
(d) नाइट्रीकरण (Nitration) -क्लोरोफॉर्म सान्द्र HNO, अम्ल से क्रिया करके नाइट्रो क्लोरोफॉर्म (क्लोरोपिक्रिन) नामक विषैली गैस बनाता है, जिसे युद्ध में विषैली गैस के रूप में प्रयुक्त किया जाता है।
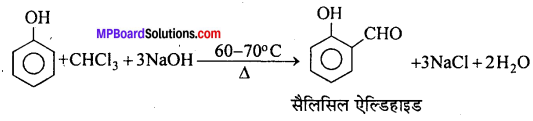
(e) राइमर-टीमैन अभिक्रिया–क्लोरोफॉर्म की सान्द्र NaOH और फीनॉल के साथ 60-70°C तक गर्म करने पर ऑर्थो सैलिसिल ऐल्डिहाइड बनता है।
प्रश्न 5.
क्लोरोबेंजीन की न्यूक्लियोफिलिक प्रतिस्थापन अभिक्रिया समझाइए।(केवल उदाहरण देकर)
उत्तर
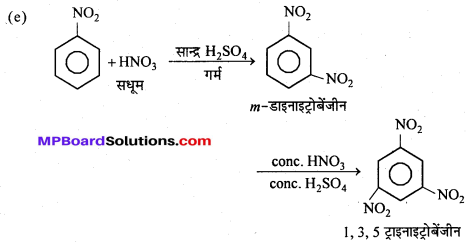
क्लोरोबेंजीन की नाभिकस्नेही प्रतिस्थापन अभिक्रियाएँ-हैलोएरीन्स में हैलोजन परमाणु सीधे बेंजीन नाभिक से अधिक मजबूती से जुड़े होने के कारण इसे न्यूक्लियोफिलिक अभिकर्मकों जैसे-OH, OR, NH2, CN आदि द्वारा सरलता से प्रतिस्थापित नहीं किया जा सकता किन्तु अधिक दाब, ताप तथा उपयुक्त उत्प्रेरक की उपस्थिति में इन समूहों द्वारा हैलोजन परमाणु का प्रतिस्थापन हो जाता है।
(1) – OH समूह द्वारा प्रतिस्थापन क्लोरोबेंजीन को 200 वायुमण्डलीय दाब और 300°C ताप पर NaOH के साथ गर्म करने पर फीनॉल बनता है।

(2) ऐल्कॉक्सी समूह (-OR) द्वारा प्रतिस्थापन –

सोडियम ऐल्कॉक्साइड के साथ मिश्रित ईथर बनता है।
(3) ऐमीनो समूहद्वारा प्रतिस्थापन-जलीय अमोनिया के साथ Cu2O की उपस्थिति में 60 वायुमण्डलीय दाब तथा 200°C ताप पर गर्म करने से ऐरोमैटिक ऐमीन बनता है।
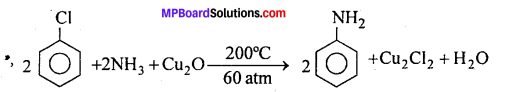
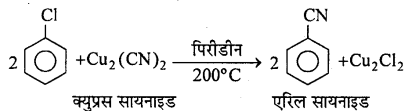
(4) सायनो समूह द्वारा प्रतिस्थापन –
![]()
प्रश्न 6.
ऐल्किल हैलाइडों में नाभिकस्नेही प्रतिस्थापन S.1 और S-2 अभिक्रिया की क्रियाविधि समझाइए।
उत्तर
नाभिकस्नेही प्रतिस्थापन अभिक्रिया–कार्बनिक यौगिक के किसी परमाणु या नाभिकस्नेही का अन्य नाभिकस्नेही समूह के द्वारा प्रतिस्थापन नाभिकस्नेही प्रतिस्थापन अभिक्रिया कहलाती है।
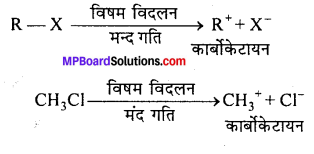
1. SN1 या एक अणुक क्रियाविधि-यह क्रिया दो चरणों में पूर्ण होती है। पहले पद में ऐल्किल हैलाइड (R-X) बंध का विदलन होता है और कार्बोकेटायन बनाता है। यह क्रिया मंद गति से होती है। द्वितीय पद में कार्बोकेटायन न्यूक्लियोफिलिक अभिकर्मक को शीघ्रता से क्रिया करके उत्पाद बनाता है। अभिक्रिया की दर प्रारम्भिक पद पर निर्भर करती है। इस पद पर संक्रमण अवस्था में केवल एक अणु भाग लेता है। इस कारण इसे एक अणुक नाभिकस्नेही प्रतिस्थापन अभिक्रिया कहते हैं।
1. प्रथम पद –
2. द्वितीय पद –
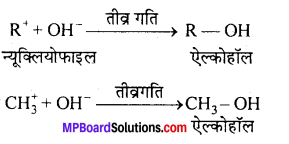
2. द्विअणुक क्रियाविधि या SN2 – इस विधि में नाभिकीय प्रतिस्थापन अभिक्रिया एक ही पद में सम्पन्न होती है। जिसके फलस्वरूप एक संक्रमण अवस्था संरचना बनाती है। जो शीघ्र ही ऐल्कोहॉल में परिवर्तित हो जाती है और हैलाइड आयन मुक्त करती है।
![]()
इस क्रिया में दो अणु भाग लेकर संक्रमण अवस्था का निर्माण करते हैं। इसलिये इसे SN2 द्विअणुक अभिक्रिया कहते हैं। इस प्रकार अभिक्रिया की दर RX और OH– आयन दोनों के मोलर सान्द्रण पर निर्भर करती है।
प्रश्न 7.
ऐल्कोहॉल द्वारा आयोडोफॉर्म बनाने की प्रयोगशाला विधि का नामांकित चित्र बनाइए एवं सम्बन्धित रासायनिक समीकरण लिखिए।
उत्तर
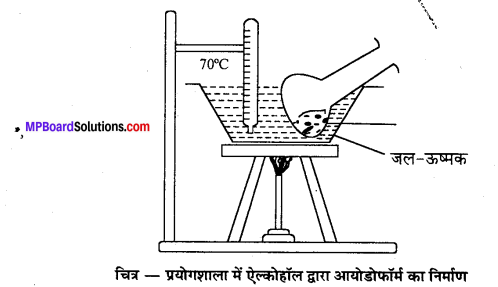
रासायनिक अभिक्रियाएँ –
प्रश्न 8.
क्लोरोबेंजीन की निम्न अभिक्रियाओं को समझाइए –
(अ) अँधेरे में FeCl3 की उपस्थिति में क्लोरीन के साथ अभिक्रिया
(ब) उल्मान (Ullmann) अभिक्रिया।
उत्तर
(अ) क्लोरोबेंजीन, क्लोरीन से FeCl3 की उपस्थिति में अँधेरे में क्रिया करके ०-डाइक्लोरोबेंजीन तथा p-डाइक्लोरोबेंजीन बनाता है।
(ब) जब ब्रोमो या आयोडो बेंजीन को 200°C ताप पर Cu के साथ सील बंद नली में गर्म किया जाता है, तो डाइफेनिल बनता है, इसे उल्मान अभिक्रिया कहते हैं।
![]()
प्रश्न 9.
क्लोरोबेंजीन की निम्न क्रियाओं के समीकरण लिखिए –
1. हैलोजनीकरण
2. नाइट्रीकरण
3. सल्फोनीकरण
4. एल्किलीकरण।
उत्तर
1. हैलोजनीकरण –
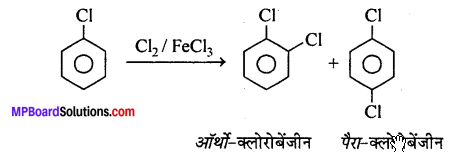
2. नाइट्रीकरण –
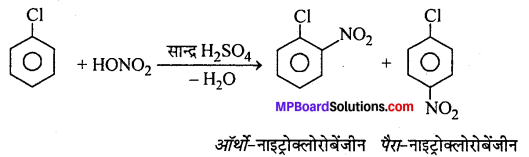
3. सल्फोनीकरण –
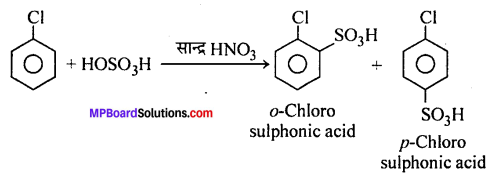
4. एल्किलीकरण –
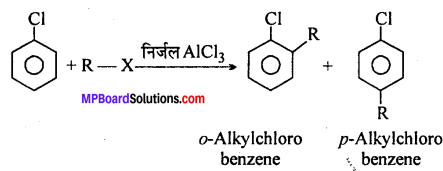
प्रश्न 10.
क्या कारण है, कि हैलोऐल्केन की तुलना से हैलोएरीन्स केम क्रियाशील होते हैं ? अथवा, एरिल हैलाइड, ऐल्किल हैलाइड की अपेक्षा कम क्रियाशील क्यों होते हैं ?
उत्तर
ऐल्किल हैलाइड की अपेक्षा एरिल हैलाइड में हैलोजन परमाणु नाभिक के साथ दृढ़ता से जुड़ा रहता है इसलिए एरिल हैलाइड का न्यूक्लियोफिलिक अभिकर्मकों द्वारा प्रतिस्थापन सरलता से नहीं होता। ऐरिल हैलाइडों की क्रियाशीलता कम होने के दो कारण हैं –
(i) हैलो ऐल्केन की अपेक्षा हैलो ऐरीन में हैलोजन परमाणु नाभिक के साथ अधिक दृढ़ता के साथ जुड़ा रहता है।

हैलो ऐरीन … (spसंकरण) हैलो ऐरीन में हैलोजन से जुड़ा हुआ कार्बन परमाणु (C-Cl) sp2 संकरित होता है, जबकि हैलो ऐल्केन में sp3 संकरित रहता है । sp2 हाइब्रिड ऑर्बिटल्स में sp3 ऑर्बिटल्स की तुलना में 5 ऑर्बिटल की प्रवृत्ति अधिक रहती है। अत: इनका आकार छोटा होता है । इलेक्ट्रॉन नाभिक के अधिक निकट रहते हैं तथा नाभिक से अधिक दृढ़ता से बंधे रहते हैं।
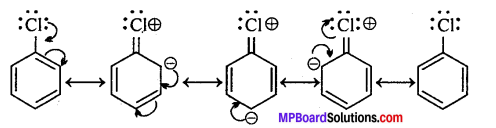
(ii) ऐरिल हैलाइड में हैलोजन परमाणु की कम क्रियाशीलता का दूसरा कारण अनुनाद है। अनुनाद के कारण C_CI बन्ध में द्विबन्ध जैसे गुण आ जाते हैं। C-CI बन्ध की लम्बाई कम हो जाती है अर्थात् CI कार्बन से अधिक दृढ़ता से जुड़ जाता है। अत: C का प्रतिस्थापन कठिन हो जाता है।
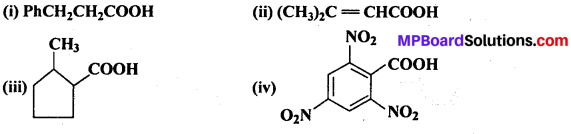
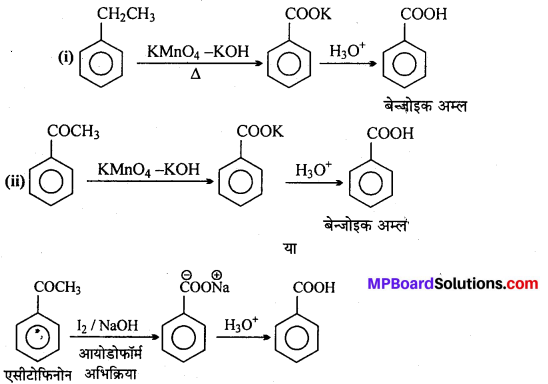
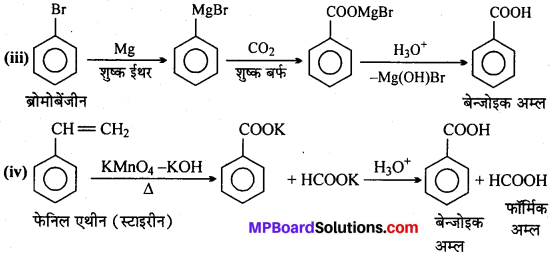
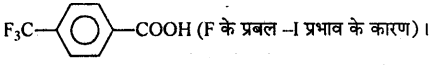
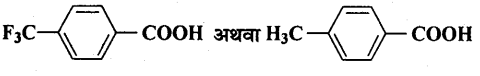
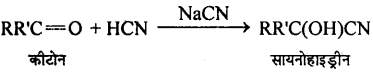
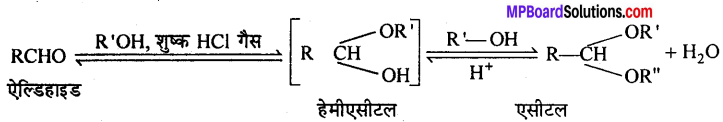
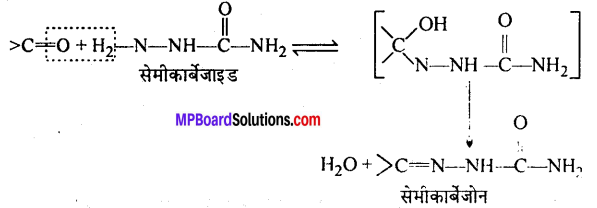
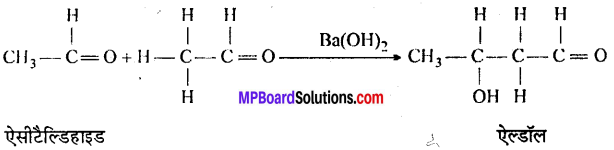
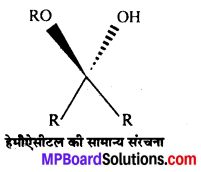
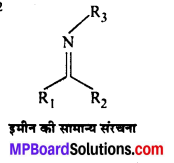
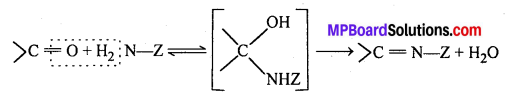
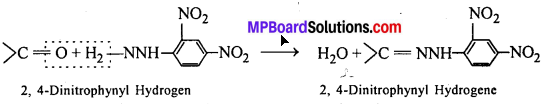
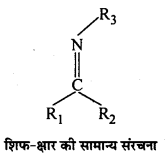

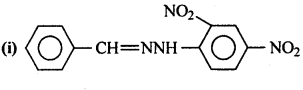
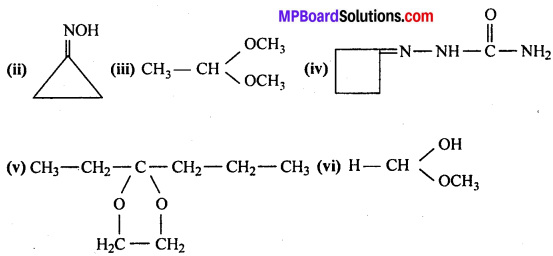
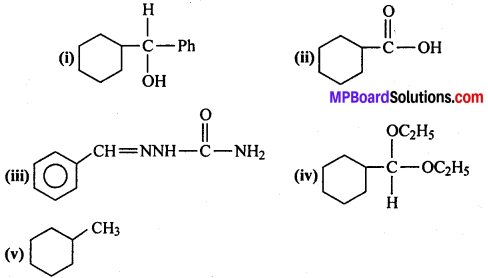
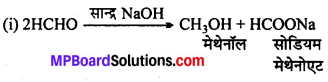
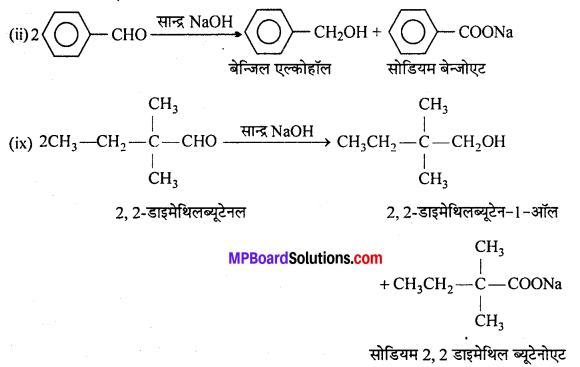
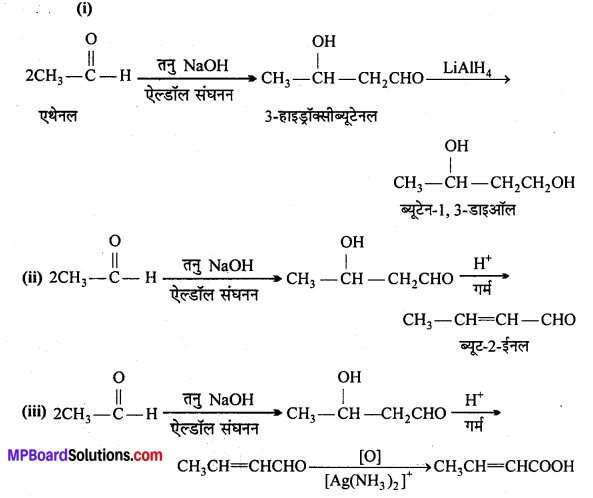
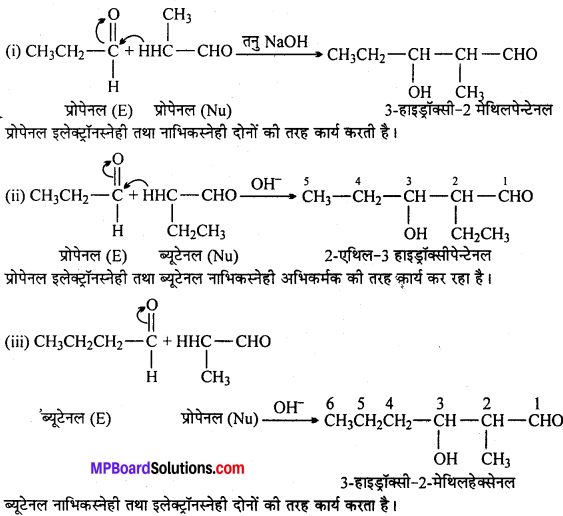
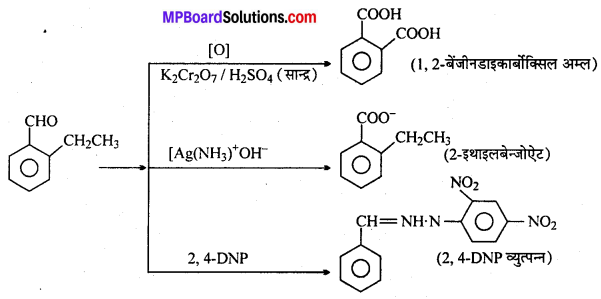

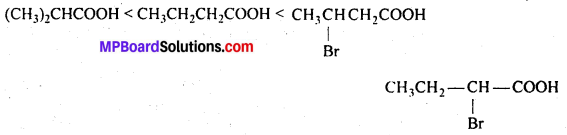
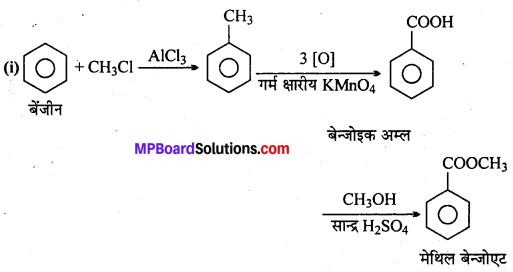
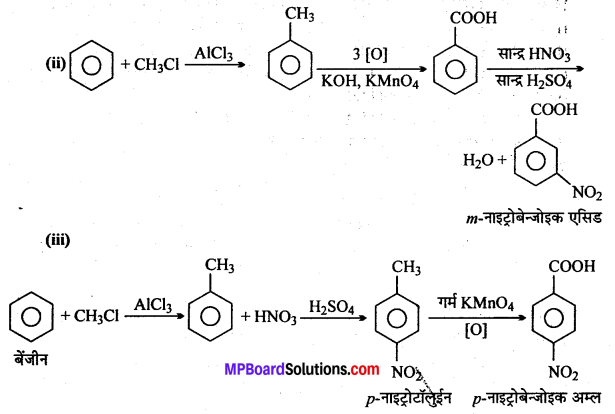
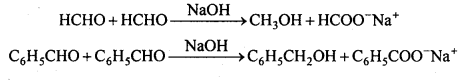
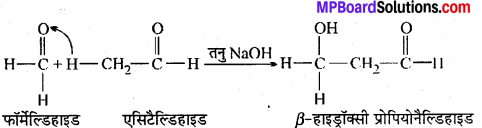
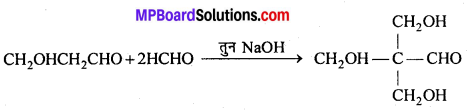
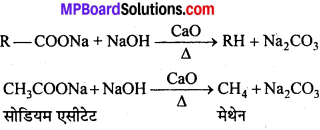
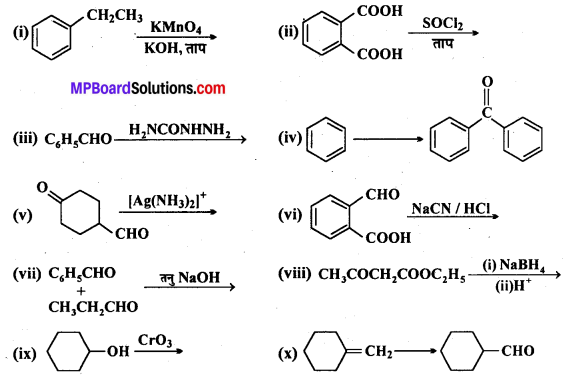
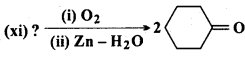
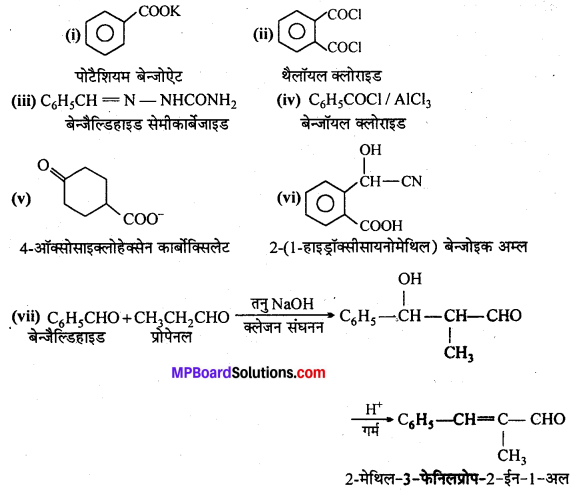
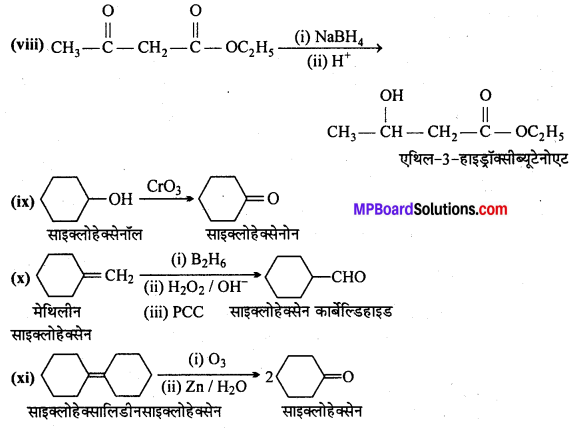


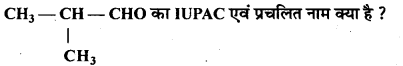
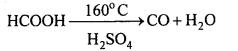
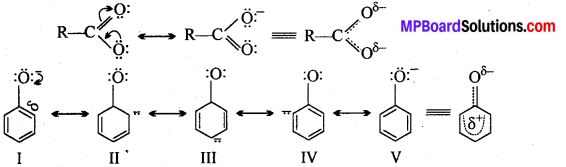
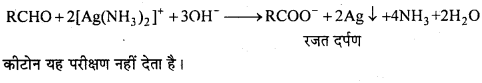

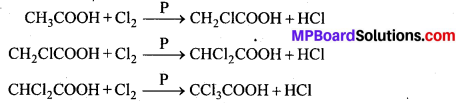
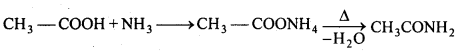
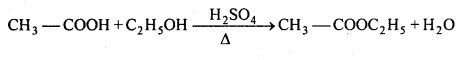
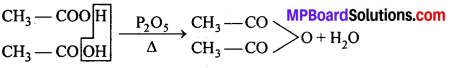
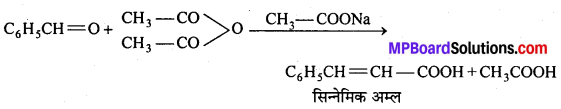
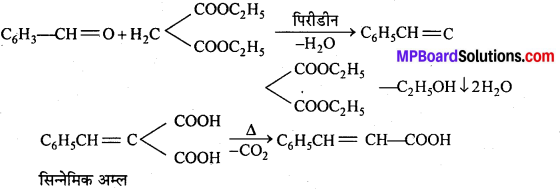
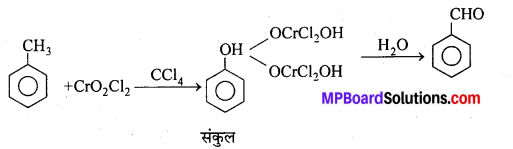
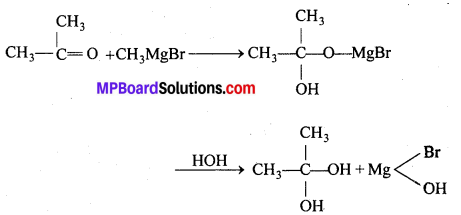
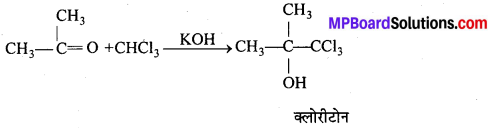
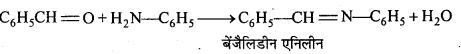
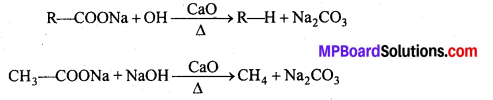
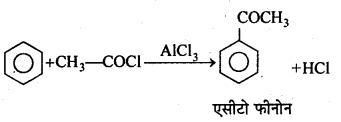
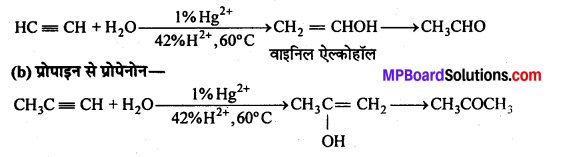
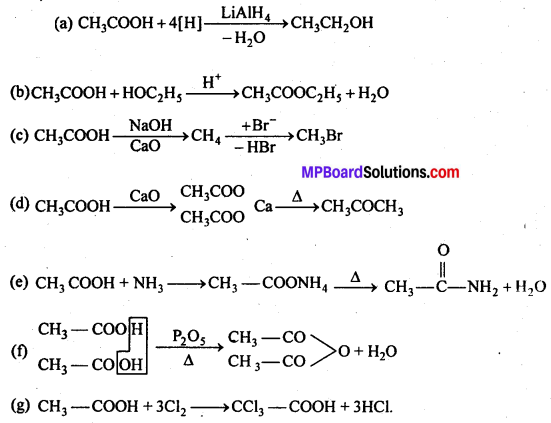
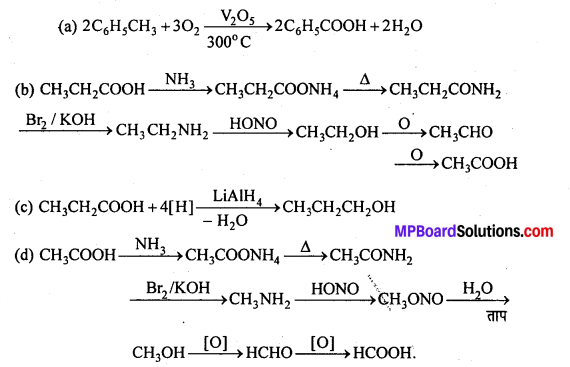
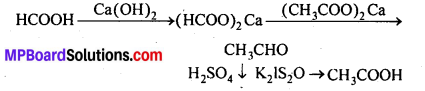
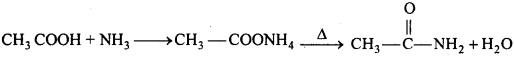
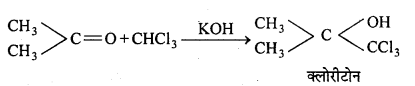
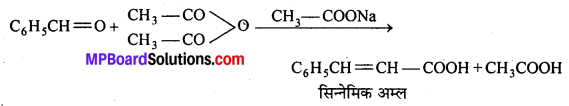
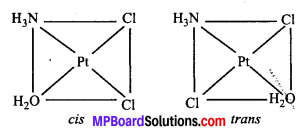

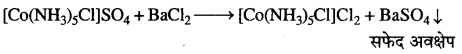
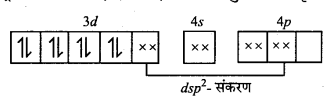
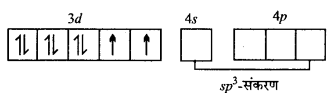


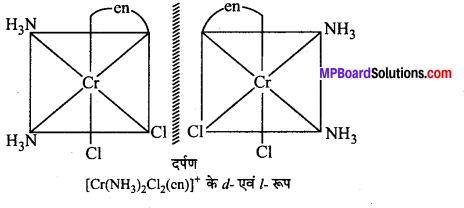
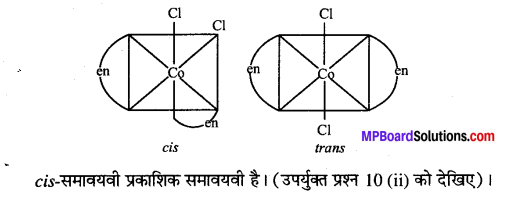
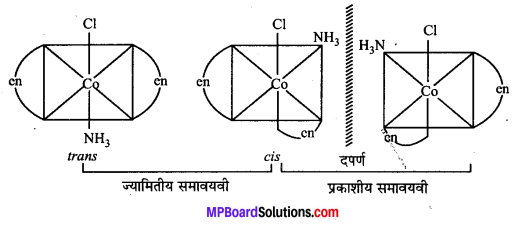
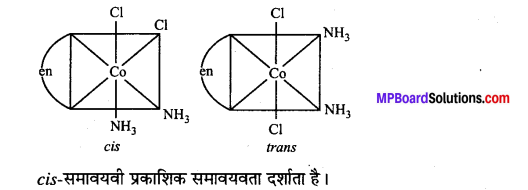
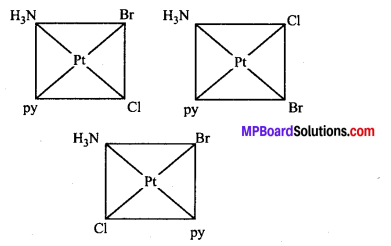


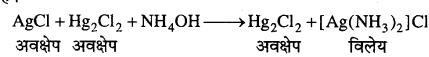
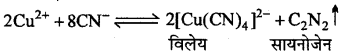
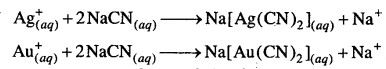



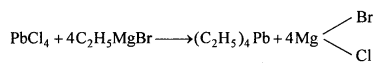
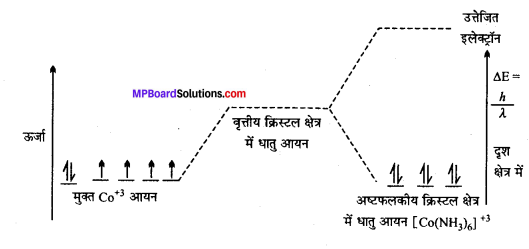

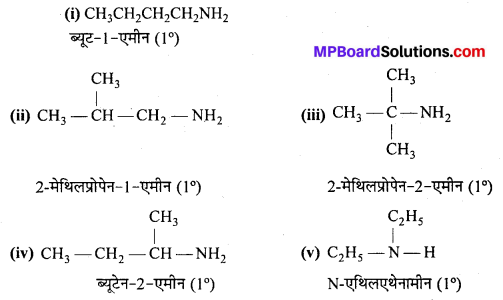
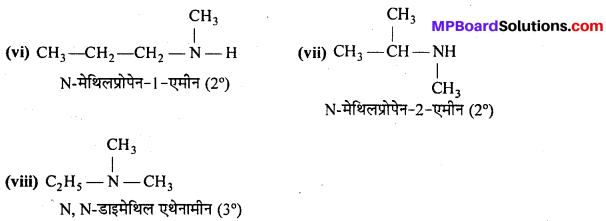
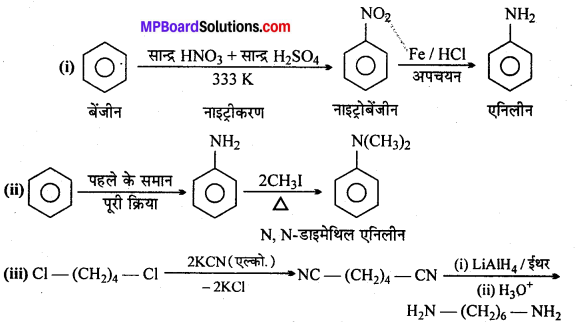
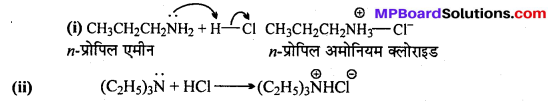
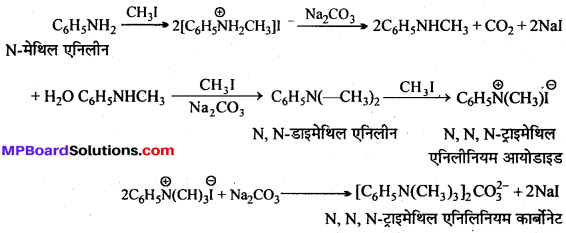
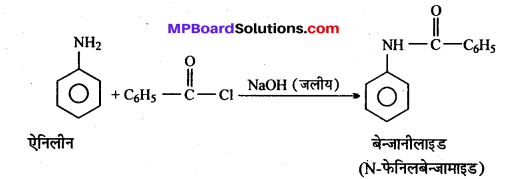

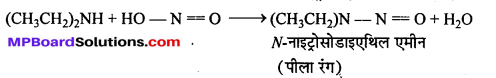
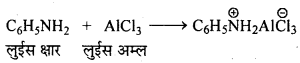
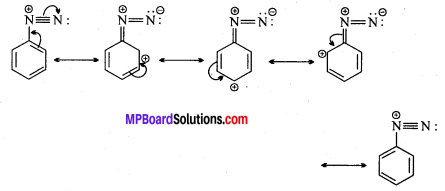
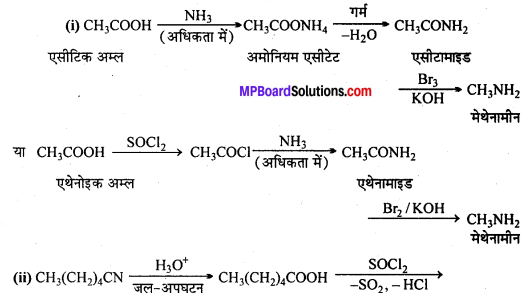
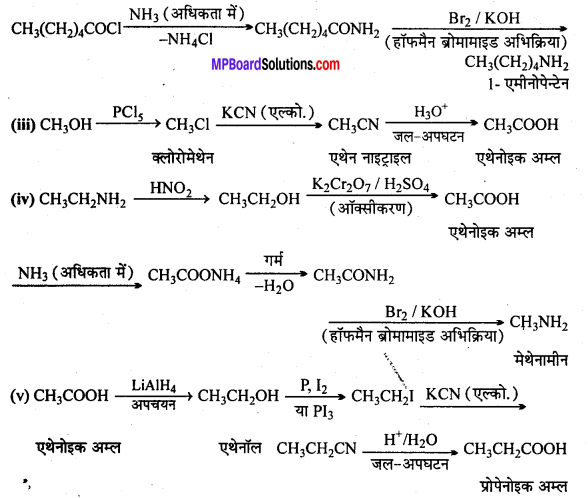
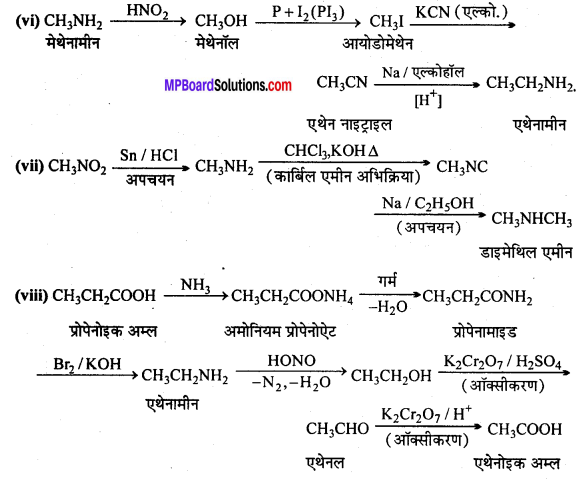
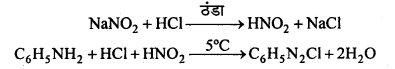
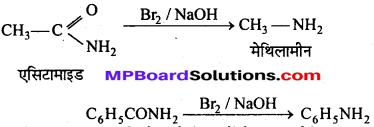
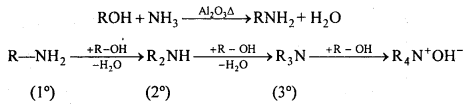
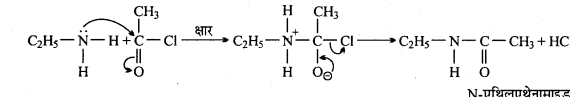
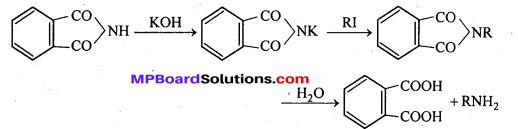
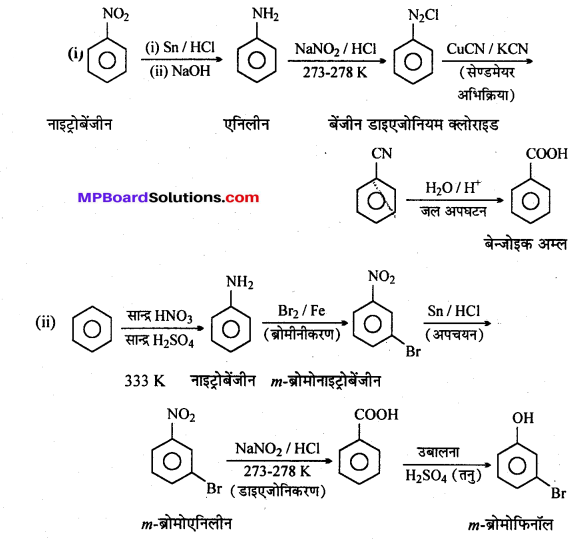
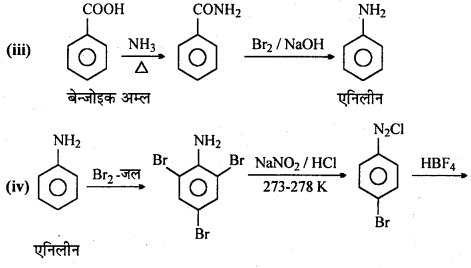
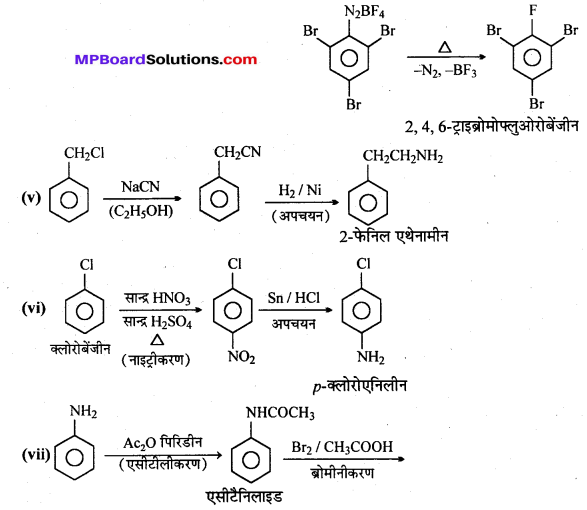
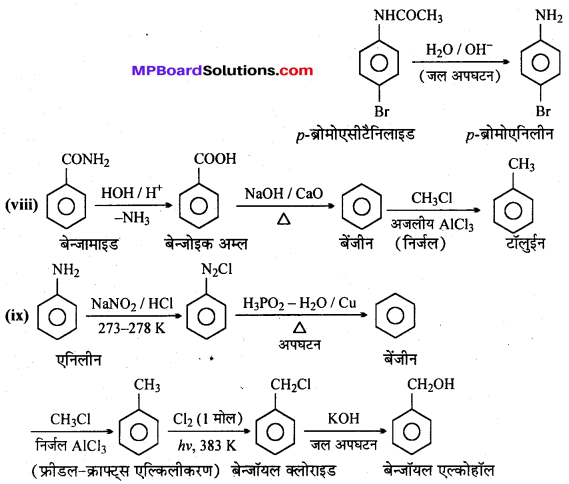
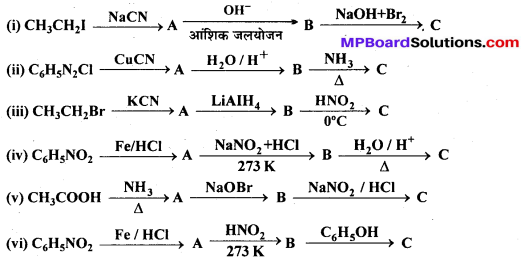
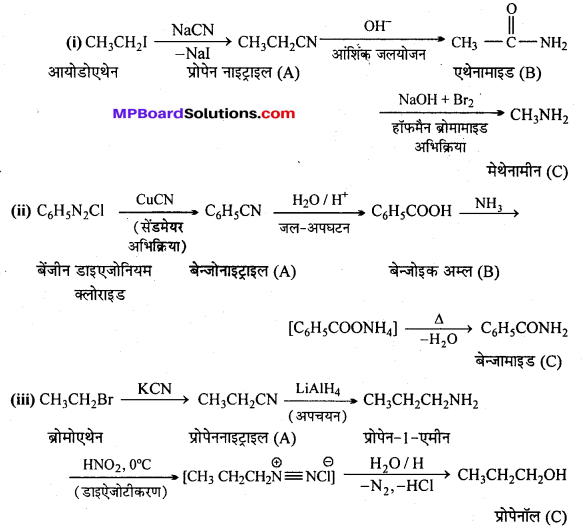
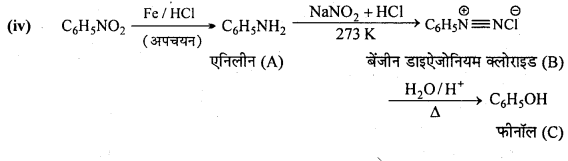
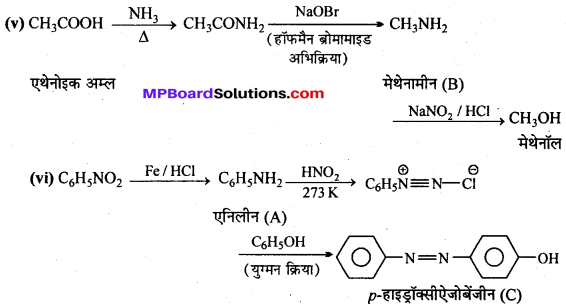
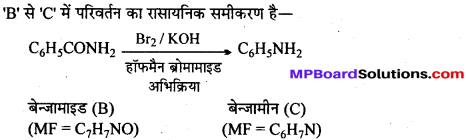
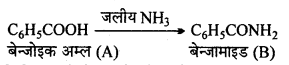
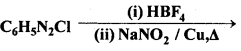
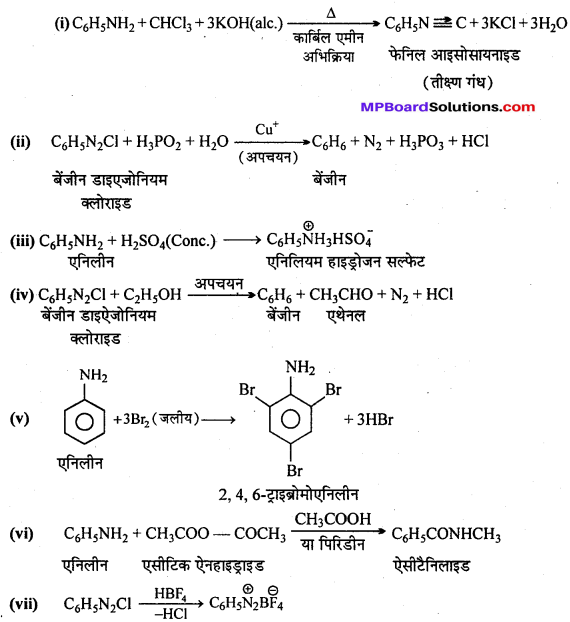
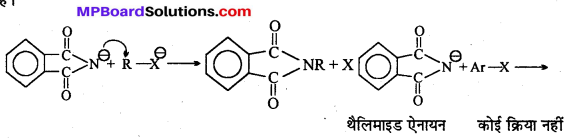
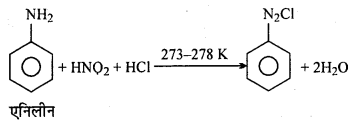
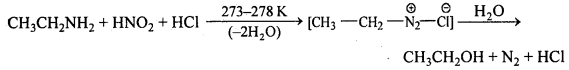
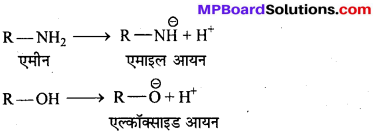
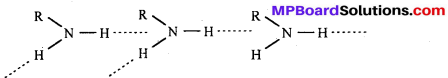
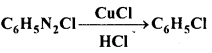 अभिक्रिया है
अभिक्रिया है


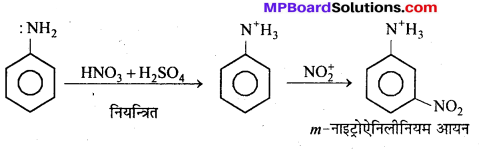
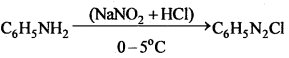 अभिक्रिया का नाम है। 0-5°C
अभिक्रिया का नाम है। 0-5°C उक्त अभिक्रिया का नाम लिखिए।
उक्त अभिक्रिया का नाम लिखिए।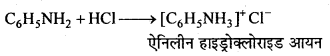
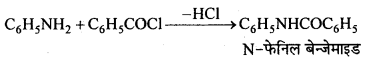
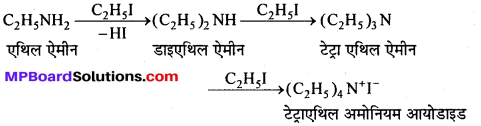
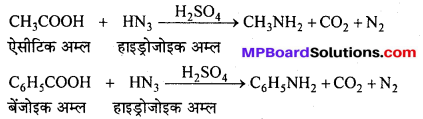
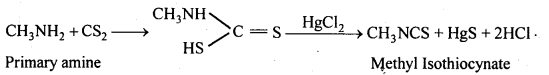
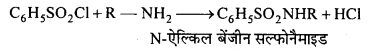
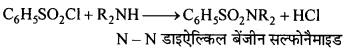
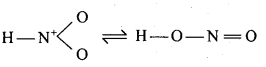
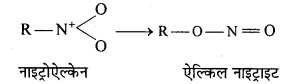
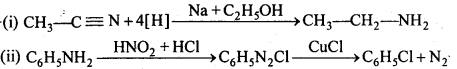
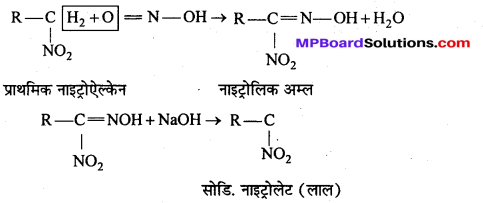
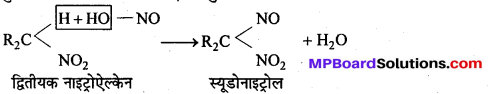
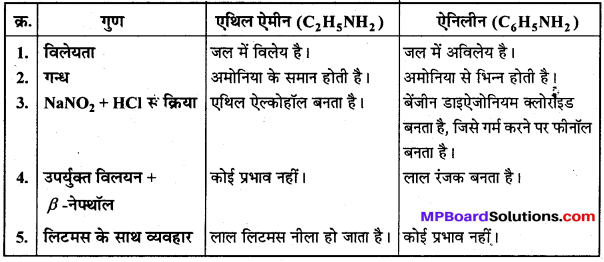
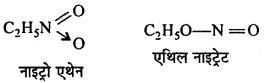
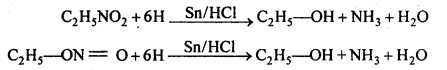
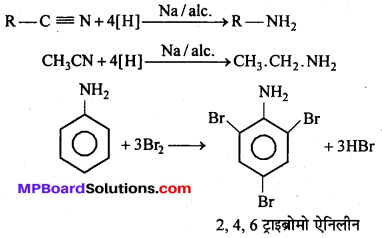
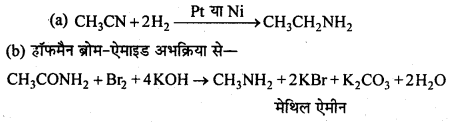
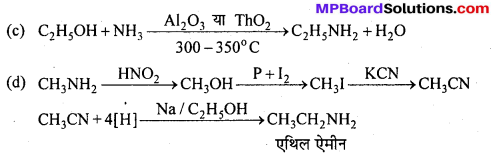
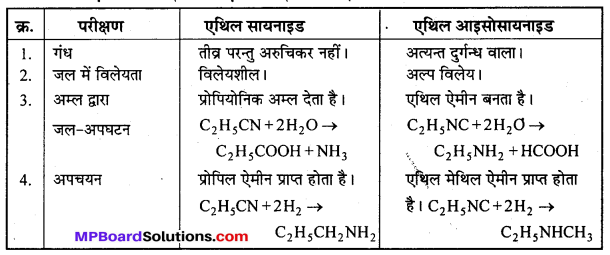
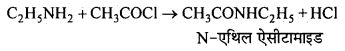
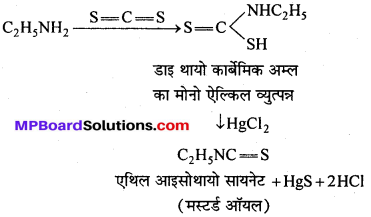
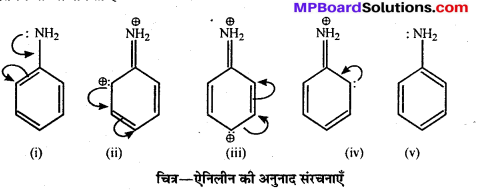
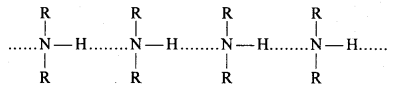
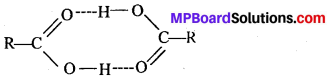
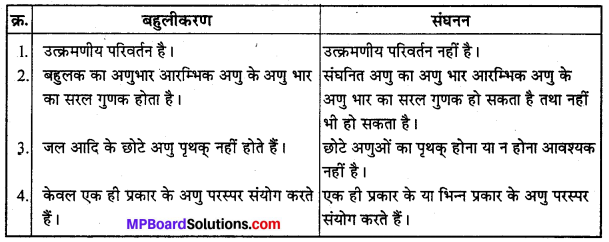
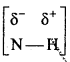 बन्ध उपस्थित होते हैं, जिससे ऐमीन में हाइड्रोजन बन्ध द्वारा अणुओं का संगुणन हो जाता है । इसी कारण इनका क्वथनांक समतुल्य अणुभार वाले ऐल्केन से अधिक होता है।
बन्ध उपस्थित होते हैं, जिससे ऐमीन में हाइड्रोजन बन्ध द्वारा अणुओं का संगुणन हो जाता है । इसी कारण इनका क्वथनांक समतुल्य अणुभार वाले ऐल्केन से अधिक होता है।