MP Board Class 11th Chemistry Solutions Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें NCERT अभ्यास प्रश्न
प्रश्न 1.
निम्नलिखित यौगिकों में प्रत्येक कार्बन पर संकरण अवस्था ज्ञात कीजिए –
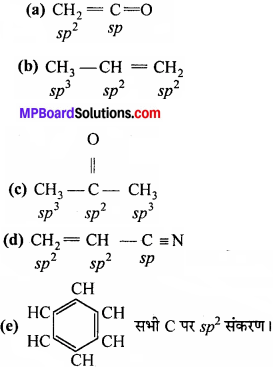
(a) CH2 = C = O
(b) CH3 – CH = CH2
(c) (CH3)2CO
(d) CH2 = CH – CN2
(e) C6H6
उत्तर:
प्रश्न 2.
(d) CH2 = C = CH2
(e) CH3NO2
(f) HCONHCH3
उत्तर:
प्रश्न 3.
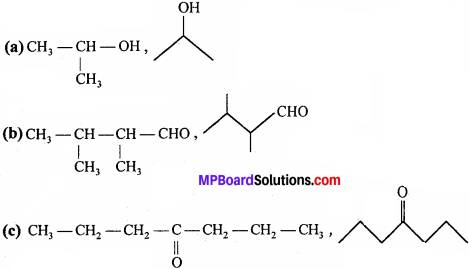
निम्नलिखित यौगिकों के आबन्ध रेखा-सूत्र लिखिए –
(a) Isopropyl alcohol
(b) 2, 3-Dimethylbutanal
(c) Heptan – 4 – one.
OH
उत्तर:
प्रश्न 4.
निम्नलिखित यौगिकों के IUPAC में नाम लिखिए –
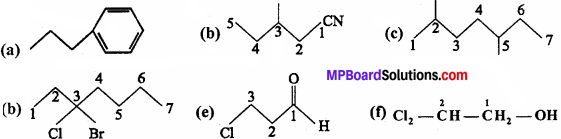
उत्तर:
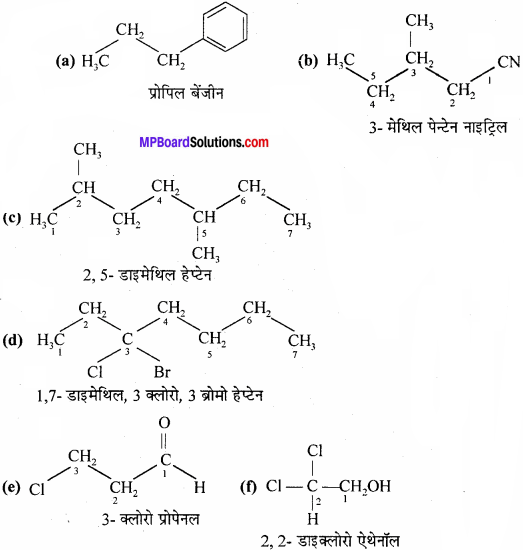
(a) Propylbenzene
(b) 3 – Methylpentanenitrile
(c) 2, 5-Dimethylheptane
(d) 3 – Bromo – 3 – chloroheptane
(e) 3 – Chloropropanal
(f) 2, 2 – Dichloroethanol.
![]()
प्रश्न 5.
निम्नलिखित यौगिकों में से कौन – सा नाम IUPAC के अनुसार सही है –
(a) 2, 2 – Diethylpentane अथवा 2 – Dimethylpentane
(b) 2, 4, 7 – Trimethyloctane अथवा 2, 5, 7 – Trimethy-loctane
(c) 2 – Chloro – 4 – methylpentane अथवा 4 – Chloro – 2,2 – methylpentane
(d) But – 3 – yn – 1 – ol अथवा But – 4 – 0l – 1 – yne.
उत्तर:
टीप-सर्वप्रथम दिये गए नाम से संरचना बना लें, फिर नियमों के अनुसार नाम दें, यदि वही नाम आता है तो सही है अन्यथा गलत है।
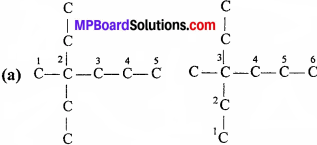
3-Ethyl-3-methylhexane होना चाहिए, अतः दिया गया नाम गलत है। 2-Dimethylpentane यह गलत है। (यहाँ Dimethyl प्रतिस्थापियों की संख्या दो होनी चाहिए, जो नहीं है।)


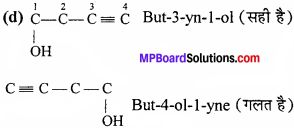
∴ अंकन दायीं तरफ से होना चाहिए था। अत: But – 3 – yn – 1 – ol सही है।
![]()
प्रश्न 6.
निम्नलिखित दो सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना सूत्र लिखिए –
(a) कार्बोक्सिलिक अम्ल / एल्केनोइक अम्ल
(b) एस्टर
(c) एल्कीन।
उत्तर:
(a) कार्बोक्सिलिक अम्ल / एल्केनोइक अम्ल (Carboxylic acid/Alkanoic acid) –
- HCOOH
- CH3COOH
- CH3 – CH2 – COOH
- CH3 – CH2 – CH2 – COOH
- CH3 – CH2 – CH2 – CH2 – COOH
(b) एस्टर (Esters)
- CH3COOCH3
- CH2CH2COOCH3
- CH2CH2COOCH CH3
- CH2CH2CH2COOCHCH3
- CH3CH2CH2COOCH2CH2CH3
(c) एल्कीन (Alkenes)
- CH2 = CH2
- CH2CH = CH2
- CH3CH2CH = CH2
- CH3CH2CH2CH = CH2
- CH2CH = CHCH2CH2CH3.
![]()
प्रश्न 7.
निम्नलिखित के संघनित और आबन्ध रेखा-सूत्र लिखिए तथा उनमें यदि क्रियात्मक समूह हो, तो उसे पहचानिए –
(a) 2, 2, 4 – Trimethylpentane
(b) 2 – Hydroxy – 1, 2, 3 – propanetricarboxylic acid
(c) Hexanedial.
उत्तर:
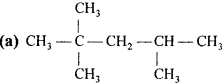
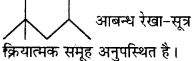
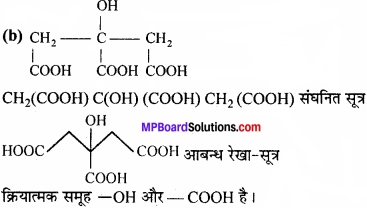
प्रश्न 8.
निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए –
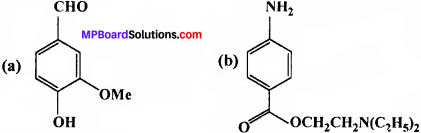

उत्तर:
(a) क्रियात्मक समूह –
- – CHO (Aldehyde)
- – OMe (Ether)
- – OH (Phenolic)
(b) क्रियात्मक समूह –
- Amino
- N, N-Diethylpropanoate,
(c) क्रियात्मक समूह –
1. COCl (Acid chloride)
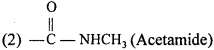
(d) क्रियात्मक समूह – एथिलीनिक द्विबन्ध, नाइट्रो।
![]()
प्रश्न 9.
निम्न में कौन अधिक स्थायी है तथा क्यों –
O2NCH2CH2O–, CH3CH2O–
उत्तर:
– CH3 – CH2O– की तुलना में O2N – CH2
CH2O– अधिक स्थायी होता है क्योंकि – NO2 समूह – I प्रभाव प्रदर्शित करता है। जिसके कारण ऋणावेश विरल होता है। दूसरी ओर – CH3समूह +I प्रभाव प्रदर्शित करता है, जिसके कारण ऋणावेश सघन हो जाता है। आवेश के विरल हो जाने के कारण आयन का स्थायित्व बढ़ता है जबकि, ऋणावेश के सघन हो जाने के कारण आयन का स्थायित्व घटता है।
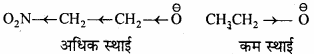
प्रश्न 10.
निकाय से आबन्धित होने पर ऐल्किल समूह इलेक्ट्रॉन दाता की तरह व्यवहार प्रदर्शित क्यों करते हैं ? समझाइए।
उत्तर:
ऐल्किल समूह में कोई एकाकी इलेक्ट्रॉन युग्म नहीं होता है परन्तु 7 – इलेक्ट्रॉन तंत्र से जुड़ने पर अतिसंयुग्मन के कारण इलेक्ट्रॉन दाता के समान व्यवहार करता है। हम इसे टॉलुईन द्वारा दिखाते हैं, जिसमें मेथिल (CH3) समूह एकान्तर स्थितियों में तीन पाई (ooo) इलेक्ट्रॉन सहित बेंजीन वलय से जुड़ा होता है। विभिन्न अनुनादी संरचनाएँ निम्न हैं –
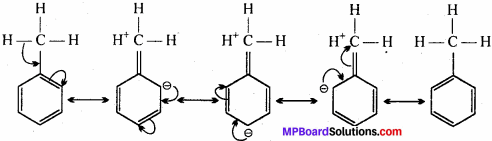
प्रश्न 11.
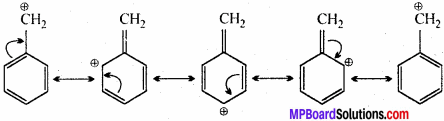
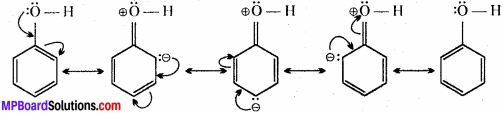
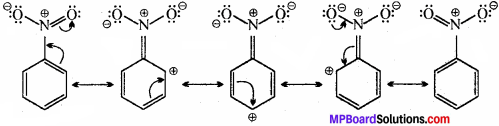
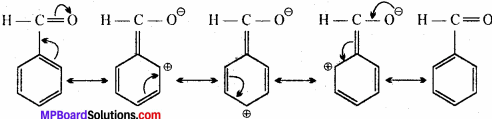
निम्नलिखित यौगिकों की अनुनादी संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए –
(a) C6H5 \(\stackrel{\ominus}{\mathbf{C}} \mathbf{H}_{2}\)
(b) C6H5OH
(c) C6H5NO2
(d) C6H5CH = O
(e) CH3 – CH = CH – CH = O
(f) CH3 – CH = CH – \(\stackrel{\ominus}{\mathbf{C}} \mathbf{H}_{2}\)
उत्तर:
(a) C6H5\(\stackrel{\ominus}{\mathbf{C}} \mathbf{H}_{2}\) में
(b) C6H5OH में
(c) C6H5NO2 में
(d) C6H5CH = O में
(e) CH3 – CH = CH – CH=0 में
![]()
(1) CH3 – CH = CH – \(\stackrel{\ominus}{\mathbf{C}} \mathbf{H}_{2}\) में
![]()
![]()
प्रश्न 12.
इलेक्ट्रॉन स्नेही तथा नाभिक स्नेही क्या है ? उदाहरण सहित समझाइए।
उत्तर:
इलेक्ट्रॉन स्नेही अभिकर्मक-वे अभिकर्मक जो इलेक्ट्रॉन के प्रति बंधुता रखते हैं, इलेक्ट्रॉन स्नेही अभिकर्मक कहलाते हैं। सभी धनावेशित आयन या ऐसे उदासीन अणु जो एक या एक से अधिक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर सकते हैं। ये उस स्थान पर आक्रमण करते हैं, जहाँ इलेक्ट्रॉन घनत्व उच्च होता है।
धनावेशित इलेक्ट्रॉन स्नेही अभिकर्मक – NH4+H3O+, Br+, Ci+,NO2+
उदासीन इलेक्ट्रॉन स्नेही अभिकर्मक – BF3,AlCl3,FeCl3
नाभिक स्नेही अभिकर्मक:
वे अभिकर्मक जो नाभिक के द्वारा आकर्षित होते हैं या नाभिक के प्रति बंधुता रखते हैं नाभिक स्नेही अभिकर्मक कहलाते हैं। ये सामान्यतः ऋण आवेशित आयन या ऐसे उदासीन अणु होते हैं, जिनके पास एक या एक से अधिक एकाकी इलेक्ट्रॉन युग्म होते हैं। ये उस स्थान पर आक्रमण करते हैं, जहाँ इलेक्ट्रॉन घनत्व कम होता है।
ऋणावेशित नाभिक स्नेही अभिकर्मक –
![]()
उदासीन नाभिक स्नेही अभिकर्मक –
![]()
प्रश्न 13.
निम्नलिखित समीकरणों में रेखांकित अभिकर्मकों को नाभिक स्नेही तथा इलेक्ट्रॉन स्नेही में वर्गीकृत कीजिए –
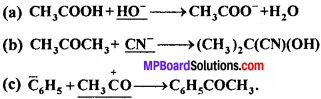
उत्तर:
- HO– → नाभिक स्नेही है।
- CN– → नाभिक स्नेही है।
- CH3 \(^{\oplus} \mathrm{C} \mathrm{O}\) → इलेक्ट्रॉन स्नेही है।
प्रश्न 14.
निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए –

(c) CH3 – CH2 – Br + OH → CH2 = CH2 + H2O + Br
(d) (CH3 )3 C – CH2 OH + HBr → (CH3 )2 CBrCH2 CH3 + H2O.
उत्तर:
(a) नाभिक स्नेही प्रतिस्थापन अभिक्रिया।
(b) नाभिक स्नेही योगात्मक अभिक्रिया
(c) विलोपन अभिक्रिया
(d) पुनर्विन्यास के साथ नाभिक स्नेही प्रतिस्थापन अभिक्रिया।
प्रश्न 15.
निम्नलिखित युग्मों में सदस्य-संरचनाओं के मध्य कैसा संबंध है? क्या वे संरचनाएँ संरचनात्मक या ज्यामिति समावयव अथवा अनुनादी संरचनाएँ हैं –
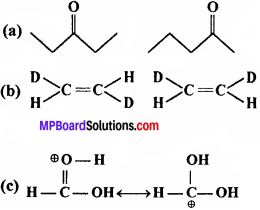
उत्तर:
(a) संरचनात्मक समावयव (क्रियात्मक समूह की स्थिति में भिन्न)
(b) ज्यामितीय समावयव

(c) अनुनाद संरचनाएँ (इलेक्ट्रॉनों की स्थिति भिन्न है, परन्तु परमाणुओं की नहीं)।
![]()
प्रश्न 16.
निम्नलिखित आबन्ध विदलनों के लिये इलेक्ट्रॉन विस्थापन को मुड़े तीरों द्वारा दर्शाइए तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिये। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त मूलक, कार्ब-धनायन तथा कार्ब – ऋणायन पहचानिए –
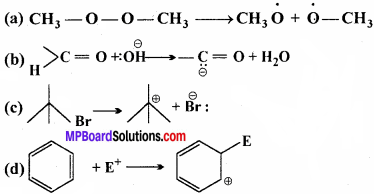
उत्तर:
![]() आबन्ध विदलन-समांश आबन्ध विदलन। प्राप्त सक्रिय मध्यवर्ती मुक्त मूलक है।
आबन्ध विदलन-समांश आबन्ध विदलन। प्राप्त सक्रिय मध्यवर्ती मुक्त मूलक है।
![]()
आबन्ध विदलन-विषमांश आबन्ध विदलन। प्राप्त सक्रिय मध्यवर्ती कार्ब-ऋणायन है।
![]()
आबन्ध विदलन-विषमांश आबन्ध विदलन। प्राप्त सक्रिय मध्यवर्ती कार्ब-धनायन है।
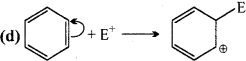
आबन्ध विदलन-विषमांश आबन्ध विदलन। प्राप्त सक्रिय मध्यवर्ती कार्ब-ऋणायन है।
प्रश्न 17.
निम्नलिखित कार्बोक्सिलिक अम्लों की अम्लता का सही क्रम, कौन-सा इलेक्ट्रॉन विस्थापन वर्णित करता है ? प्रेरणिक तथा इलेक्ट्रोमेरिक प्रभावों की व्याख्या कीजिए –
(a) Cl3 CCOOH >CI2 CHCOO > CICH2COOH
(b) CH3 – CH2 – COOH>(CH3 )2 CHCOOH> (CH3)3 C – COOH.
उत्तर:
(a) प्रेरणिक प्रभाव:
संतृप्त कार्बन श्रृंखला के छोर पर इलेक्ट्रॉनग्राही या दाता परमाणु उपस्थित हो तब (σ) सिग्मा इलेक्ट्रॉन का बहाव होता है। संतृप्त कार्बन श्रृंखला में यह σ इलेक्ट्रॉन गति प्रेरणिक प्रभाव कहलाता है। प्रेरणिक प्रभाव शृंखला बढ़ने से पहले घटता है। तीन चार कार्बन परमाणु के बाद प्रेरणिक प्रभाव खत्म हो जाता है। प्रेरणिक प्रभाव दो प्रकार का होता है।
1. यदि श्रृंखला के अंत में इलेक्ट्रॉनग्राही परमाणु जुड़ा होता है तब -I प्रेरणिक प्रभाव उत्पन्न होता है।
![]()
-I प्रेरणिक प्रभाव निम्न क्रम में घटता है –
NO,> – CN > – COOH >- F > – Cl>- Br >- I
2. यदि श्रृंखला के अन्त में इलेक्ट्रॉनदाता परमाणु जुड़ा होता है तथा + I प्रेरणिक प्रभाव उत्पन्न होता है।
![]()
यह प्रभाव निम्न क्रम में घटता है –
(CH3)3C – >(CH3)2CH – >CH3 – CH2 – >CH3 – >D > H
यह प्रभाव स्थायी है इस प्रभाव के कारण अणुओं के उच्च क्वथनांक, गलनांक और द्विआघूर्ण ध्रुवण होता है।
(b) इलेक्ट्रोमेरिक प्रभाव-यह एक अस्थायी प्रभाव है। केवल आक्रमणकारी अभिकारकों की उपस्थिति में यह प्रभाव बहुआबंध वाले कार्बनिक यौगिकों में प्रदर्शित होता है, इसमें आक्रमण करने वाले अभिकारक की माँग के कारण बहु-आबंध से बंधित परमाणुओं में एक सहभाजित 7 – इलेक्ट्रॉन युग्म का पूर्ण विस्थापन होता है यह प्रभाव दो प्रकार का होता है।
![]()
+E और -E प्रभाव – यदि बहुआबंध के -इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित होता है + E प्रभाव कहलाता है, उदाहरणार्थ

यदि बहुआबंध के π – इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित नहीं होता है, – E प्रभाव कहलाता है।
![]()
प्रश्न 18.
प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धान्तों का संक्षिप्त विवरण दीजिए –
(a) क्रिस्टलन
(b) आसवन
(c) क्रोमैटोग्राफी।
उत्तर:
(a) क्रिस्टलन:
इस विधि में अशुद्ध यौगिक का शुद्ध क्रिस्टलों में रूपांतरण होता है। यह किसी उचित विलायक में यौगिक तथा अशुद्धि की विलेयताओं में अंतर पर आधारित है। अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं जिससे यौगिक सामान्य ताप पर अल्प विलेय होता है, परन्तु उच्चतर ताप पर यथेस्ट मात्रा में घुल जाता है।
इसके पश्चात् विलयन को इतना सांद्रित करते हैं कि वह लगभग संतृप्त हो जाए। विलयन को ठंडा करने पर शुद्ध पदार्थ क्रिस्टलीय हो जाता है। उदाहरण – आयोडोफॉर्म, एल्कोहॉल के साथ क्रिस्टलित हो जाता है। नैफ्थ्लीन के साथ मिश्रित बेंजोइक अम्ल गर्म जल द्वारा शोधित हो जाता है।
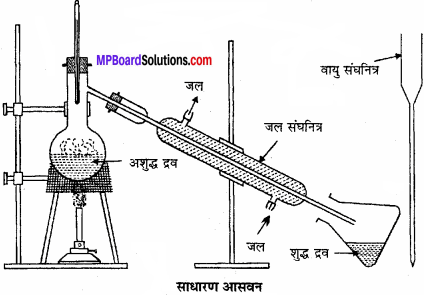
(b) आसवन:
इस विधि में अशुद्ध द्रव को गर्म करके वाष्प में बदलते हैं तथा पुनः वाष्प को ठंडा करके द्रव में बदलते है। यह विधि केवल ऐसे द्रवों के शोधन के लिए उपयुक्त है, जो वायुमण्डलीय दाब पर बिना अपघटित हुए उबलते हैं तथा जिनमें अवाष्पशील अशुद्धियाँ मिली हुई हो। ऐसे दो द्रव, जिनके क्वथनांकों मे पर्याप्त अंतर हो, का पृथक्करण एवं शोधन भी इस विधि द्वारा कर सकते हैं।
उदाहरण के लिए, क्लोरोफॉर्म (क्वथनांक 334 K) तथा ऐनिलीन (क्वथनांक 457 K), आसवन विधि द्वारा सरलतापूर्वक पृथक् किए जाते हैं। उबालने पर, कम क्वथनांक वाले द्रव की वाष्प पहले बनती है, अतः इसे ठंडा करके पहले ग्राही में एकत्रित कर लिया जाता है।
(c) क्रोमैटोग्राफी (वर्णलेखन):
वर्णलेखन, यह मिश्रण के अवयवों के पृथक्करण, शुद्धिकरण तथा पहचान की विधि है। यह मिश्रण के अवयवों के दो प्रावस्था तथा गतिशील प्रावस्था पर विशिष्ट अधिशोषण के सिद्धांत पर आधारित है। स्थिर प्रावस्था ठोस या द्रव हो सकती है जबकि गतिशील प्रावस्था द्रव या गैस होती है।
अधिशोषण वर्णलेखन के प्रकार:
- स्तंभ वर्णलेखन
- पतली परत वर्णलेखन
- वितरण वर्णलेखन।
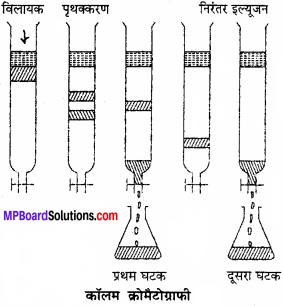
स्तंभ वर्णलेखन में, स्थिर प्रावस्था ठोस तथा गतिशील प्रावस्था विभिन्न ध्रुवता के विलायकों का मिश्रण होती है। ठोस अधिशोषण को किसी उचित अध्रुवीय विलायक के साथ उपयुक्त लम्बाई की लंबी काँच की नली में लेते हैं। पृथक् तथा शुद्ध करने वाले कार्बनिक मिश्रण के सान्द्र विलयन की कुछ मात्रा को स्तम्भ के ऊपरी भाग में अधिशोषित कर देते हैं। विभिन्न यौगिकों के अधिशोषण की मात्रा के आधार पर उनका पृथक्करण हो जाता है। मिश्रण के अवयवों को अलग-अलग परतों, जिन्हें बैण्ड (क्रोमैटोग्राम) कहते हैं, के रूप में पृथक् कर लेते हैं।
![]()
प्रश्न 19.
ऐसे दो यौगिक, जिनकी विलेयताएँ विलायक S से भिन्न है, को पृथक् करने की विधि की व्याख्या कीजिए।
उत्तर:
दो यौगिक जिनकी घुलनशीलता अलग:
अलग होती है, को प्रभाजी आसवन विधि द्वारा अलग किया जाता है। ऐसे द्रवों के वाष्प इसी तप्त परास में बन जाते हैं तथा साथ-साथ संघनित हो जाते हैं। ऐसी अवस्था में प्रभाजी आसवन का उपयोग किया जाता है। जब गर्म विलयन को ठंडा किया जाता है, तब कम घुलनशील पदार्थ क्रिस्टल के रूप में बाहर आ जाता है, तथा अधिक घुलनशील द्रव में (विलयन) रह जाता है। दोबारा गर्म कर दूसरे का क्रिस्टलन किया जाता है।
प्रश्न 20.
निम्न दाब पर आसवन तथा भाप आसवन में क्या अन्तर है ? विवेचना कीजिए।
उत्तर:
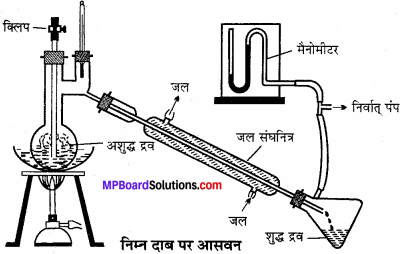
निम्न दाब पर आसवन:
यह विधि उन कार्बनिक द्रवों के लिए उपयुक्त है, जो अपने क्वथनांक से पूर्ण ताप पर ही अपघटित हो जाते हैं। किसी द्रव का वाष्पदाब वायुमण्डलीय दाब के बराबर होने पर यह उबलने लगता है। ऐसे द्रवों के पृष्ठ पर कम दाब करके उनके क्वथनांक से कम ताप पर उबाला जाता है। दाब कम करने के लिए जल पम्प अथवा निर्वात् पम्प का प्रयोग करते हैं। साबुन उद्योग में सह-उत्पाद, शेष लाई से ग्लिसरॉल को इस विधि द्वारा पृथक् करते हैं।
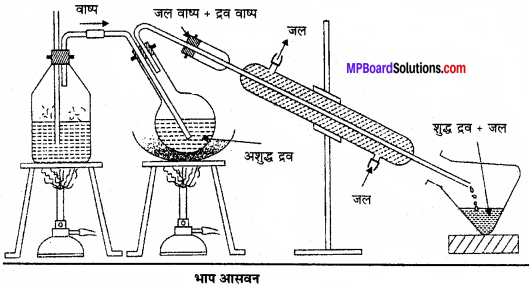
भाप आसवन:
यह जल के साथ सहसंघनन की विधि है। यह विधि उन पदार्थों के शोधन के लिए उपयुक्त है जो भाप वाष्पशील हो, परन्तु जल में अमिश्रणीय हो। ऐनिलीन को ऐनिलीन जल मिश्रण से इस विधि द्वारा पृथक करते हैं । इस विधि में कार्बनिक द्रव के वाष्प दाब (P1) तथा जल को वाष्प दाब (P2) का योग वायुमण्डलीय दाब (P) के बराबर होने पर द्रव उबलता है (अर्थात् P = P1 + P2) चूँकि P का मान P से कम है। अतः द्रव अपने क्वथनांक से कम ताप पर ही वाष्पित हो जाता है।
प्रश्न 21.
लैसेग्ने-परीक्षण का रसायन-सिद्धान्त समझाइए।
उत्तर:
लैसेग्ने निष्कर्ष का निर्माण:
सर्वप्रथम कार्बनिक यौगिक को संलयन नलिका में सोडियम धातु के साथ संगलित करते हैं। लाल तप्त नलिका को आसुत जल में तोड़कर गर्म करके, छान लेते हैं। छनित लैसेग्ने निष्कर्ष कहलाता है। यह दिए गए कार्बनिक यौगिक में N, S तथा हैलोजन की पहचान में प्रयुक्त होता है।
नाइट्रोजन का परीक्षण:
![]()
लैसेग्ने निष्कर्ष को फेरस सल्फेट विलयन के साथ गर्म करके सान्द्र H2SO4 के साथ अम्लीकृत करने पर निम्न अभिक्रियाएँ होती हैं –

गर्म करने पर कुछ Fe2+ आयन Fe3+ आयनों में ऑक्सीकृत हो जाते है।

प्रशियन ब्लू रंग की उपस्थिति, यौगिक में नाइट्रोजन की उपस्थिति को दर्शाती है।
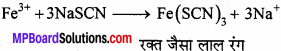
नाइट्रोजन तथा सल्फर संयुक्त परीक्षण:

सोडियम थायोसायनेट सोडियम थायोसायनेट रक्त जैसा लाल रंग देता है तथा नाइट्रोजन के परीक्षण की भाँति प्रशियन ब्लू रंग उत्पन्न नहीं होता है, क्योंकि इस क्रिया में मुक्त सायनाइड आयन उपस्थित नहीं होते हैं।
सल्फर का परीक्षण –
![]()
1. लेड एसीटेड को लैसेग्ने निष्कर्ष में मिलाकर, ऐसीटिक अम्ल के साथ अम्लीकृत करने पर, PbS का काला अवक्षेप प्राप्त होता है।
Na2S + (CH3COO)2 Pb → PbS + 2CH3COONa
2. सोडियम नाइट्रोप्रुसाइड विलयन को जैसेग्ने निष्कर्ष में मिलाने पर, सोडियम थायोनाइट्रोप्रसाइड बनने के कारण बैंगनी रंग उत्पन्न होता है।
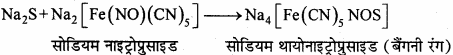
हैलोजनों का परीक्षण:
यदि लैसेग्ने निष्कर्ष में N तथा S उपस्थित हो तो सर्वप्रथम इसे सान्द्र HNO3 के साथ गर्म करके यौगिक में उपस्थित सोडियम सायनाइट या सोडियम सल्फाइट को अपघटित करते हैं, अन्यथा ये आयन हैलोजन के सिल्वर नाइट्रेट परीक्षण में बाधा उत्पन्न करते हैं।

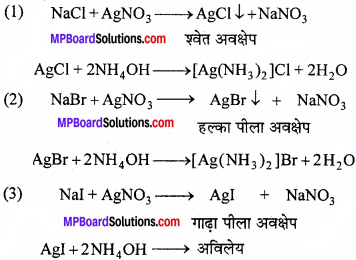
विलयन को ठंडा करते हैं तथा इसमें AgNO3 विलयन का कुछ मात्रा डालते हैं तथा निम्न प्रेक्षण देखते हैं –
1. यदि सफेद अवक्षेप (AgCl) प्राप्त होता है जो NH3(aq) में विलेय परन्तु HNO3में अविलेय हो तो कार्बनिक यौगिक में क्लोरीन उपस्थित है।
![]()
2. यदि हल्का पीला अवक्षेप (AgBr) प्राप्त होता है जो अमोनियम हाइड्रॉक्साइड विलयन में अल्पविलेय हो तो कार्बनिक यौगिक में ब्रोमीन की पुष्टि होती है।
![]()
3. यदि पीला अवक्षेप (Agl) प्राप्त हो जो अमोनियम हाइड्रॉक्साइड में अविलेय हो तो कार्बनिक यौगिक में आयोडिन की पुष्टि होती है।
![]()
प्रश्न 22.
किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की –
1. ड्यूमा विधि तथा
2. जेल्डॉल विधि के सिद्धान्त की रूप-रेखा प्रस्तुत कीजिए।
उत्तर:
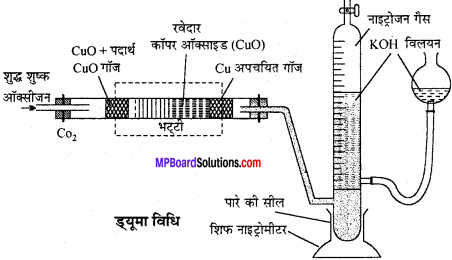
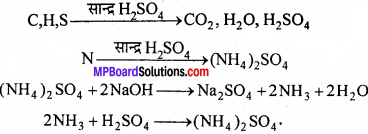
1. ड्यूमा विधि से नाइट्रोजन के आकलन:
इस विधि का उपयोग उन सभी कार्बनिक यौगिकों के लिए होता है जो नाइट्रोजन तत्व रखते हैं। इस विधि में नाइट्रोजन युक्त कार्बनिक यौगिक को कार्बन डाइऑक्साइड के साथ गर्म करने पर नाइट्रोजन मुक्त होती है। कार्बन तथा हाइड्रोजन क्रमशः कार्बन डाइऑक्साइड एवं जल में परिवर्तित हो जाते हैं।
माना कार्बनिक यौगिक का द्रव्यमान =M gm
नाइट्रोजन का आयतन = V2 ml

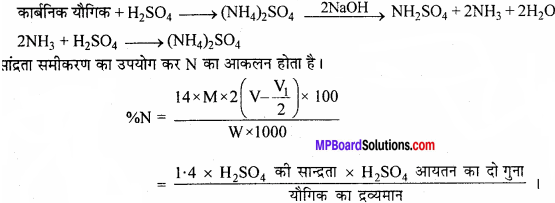
2. जेल्डॉल विधि से नाइट्रोजन के आकलन:
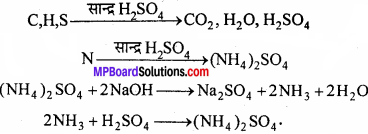
इस विधि में नाइट्रोजन युक्त यौगिक को सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है। फलस्वरूप यौगिक नाइट्रोजन अमोनियम सल्फेट में परिवर्तित हो जाती है। तब प्राप्त अम्लीय मिश्रण को सोडियम हाइड्रॉक्साइड के आधिक्य के साथ गर्म करने पर अमोनिया मुक्त होती है।
जिसे मानक सल्फ्यूरिक अम्ल विलयन के ज्ञात आयतन में अवशोषित कर लिया जाता है। इसके बाद अवशिष्ट सल्फ्यूरिक अम्ल को क्षार के मानक विलयन द्वारा अनुमापित कर लिया जाता है। अम्ल की प्रारंभिक मात्रा और अभिक्रिया के बाद शेष मात्रा के बीच अंतर से अमोनिया के साथ अभिकृत अम्ल की मात्रा प्राप्त होती है।
प्रश्न 23.
किसी यौगिक में हैलोजन, सल्फर तथा फॉस्फोरस के आकलन के सिद्धान्त की विवेचना कीजिए।
उत्तर:
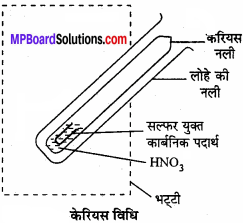
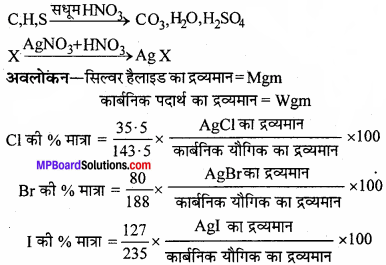
1. हैलोजन का आकलन:
कार्बनिक यौगिक की निश्चित मात्रा को केरियस नली में लेकर सिल्वर नाइट्रेट की उपस्थिति में सधूम नाइट्रिक अम्ल के साथ भट्ठी में गर्म किया जाता है। यौगिक में उपस्थित कार्बन तथा हाइड्रोजन इन परिस्थितियों में क्रमशः कार्बन डाइऑक्साइड तथा जल में ऑक्सीकृत हो जाते हैं, जबकि हैलोजन संगत सिल्वर हैलाइड AgX में परिवर्तित हो जाता है।
1 मोल AgX = 1 मोल X
mg AgX में हैलोजन का द्रव्यमान

2. सल्फर का आकलन:
इस विधि में सल्फर को H2SO4 में बदलकर अवक्षेप के रूप में बदलते हैं, जो BaCl2 में संभव है।
C+ 2O → CO2
2H + O → H2O
S + H2O + 3O → H2SO4
H2SO4 + BaCl2 → BaSO4 + 2HCl
BaSO4 अवक्षेप को धोकर सुखाते हैं और S का % ज्ञात करते हैं।

3. फॉस्फोरस का आकलन:
कार्बनिक यौगिक की एक ज्ञात मात्रा को सधुम नाइट्रिक अम्ल के साथ गर्म करने पर उसमें उपस्थित फॉस्फोरस, फॉस्फोरिक अम्ल में ऑक्सीकृत हो जाता है। इसे अमोनिया तथा अमोनियम मॉलिब्डेट मिलाकर अमोनियम फॉस्फोमॉलिब्डेट (NH4)3 PO12MoO3 के रूप में अवक्षेपित करते हैं। या फॉस्फोरिक अम्ल में मैग्नीशियम मिश्रण मिलाकर Mg2NH4PO4 के रूप में अवक्षेपित किया जा सकता है। जिसके ज्वलन से Mg2P2O7 प्राप्त होता है।

प्रश्न 24.
पेपर क्रोमैटोग्राफी के सिद्धान्त को समझाइए।
उत्तर:
किसी भी पदार्थ का वितरण दो अलग-अलग प्रावस्थाओं में, जो एक-दूसरे के संपर्क में होती हैं, अलग-अलग होता है। यह वितरण, वितरण नियम का पालन करते हुए होता है। पेपर क्रोमैटोग्राफी इसका उदाहरण है। फिल्टर पेपर के समान अत्यंत महीन सरंध्र पेपर होता है जिसे क्रोमैटोग्राफी पेपर कहा जाता है। यह पेपर स्थिर प्रावस्था प्रदान करता है।
कार्ड बोर्ड यदि इस पेपर के एक सिरे को किसी उपयुक्त विलायक या विलायक के मिश्रण में डुबो दिया जाये तो केशिका क्रिया द्वारा विलायक ऊपर चढ़ने लगता है, यह चलित प्रावस्था होती है। अब कोई पदार्थ इस चलित द्रव प्रावस्था तथा क्रोमैटोग्राफी पेपर जिसमें 6 जल उपस्थित है तथा स्थिर द्रव प्रावस्था निर्मित करता है, इन दो प्रावस्थाओं में विलायक वितरण नियमानुसार वितरित होता है।
मिश्रण में अलग-अलग घटकों का वितरण अलग-अलग होने के कारण घटक अलग – अलग दूरी तय करते हुए ऊपर चढ़ते हैं, इस प्रकार निरंतरता से होने वाले वितरण के तहत हम घटकों का पृथक्करण कर पाते हैं। पेपर क्रोमैटोग्राफी के लिये क्रोमैटोग्राफी पेपर अलग-अलग आकार में लिया जा सकता है। एक फीते के रूप में तथा बेलनाकार आवरण के रूप में लिये जाने वाले पेपर को चित्र में प्रदर्शित किया गया है।
जिन घटकों का पृथक्करण करना है, उनके मिश्रण का एक धब्बा पेपर के एक सिरे में कुछ ऊपर लगाते हैं तथा उस सिरे को उपयुक्त विलायक में डुबाते हैं। कुछ समय पश्चात् हम देखते हैं कि घटक दो प्रावस्थाओं के बीच वितरण के आधार पर ऊपर चढ़कर अलग-अलग दूरी पर पृथक् हो जाते हैं।
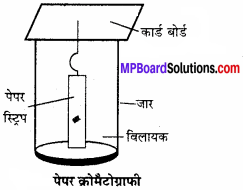
प्रश्न 25.
सोडियम संगलन निष्कर्ष में हैलोजन के परीक्षण के लिए AgNO3 मिलाने से पूर्व नाइट्रिक अम्ल क्यों मिलाया जाता है ?
उत्तर:
यदि कार्बनिक यौगिक में हैलोजन के अतिरिक्त S तथा N उपस्थित हैं तो सोडियम निष्कर्ष में उपस्थित NaCN तथा Na2S, सिल्वर नाइट्रेट के साथ अभिक्रिया करके अवक्षेप देते हैं और हैलोजन के परीक्षण में बाधा उत्पन्न नहीं करते हैं। लेकिन सोडियम निष्कर्ष में सांद्र HNO3 मिलाने से ये NaCN तथा Na2S अपघटित हो जाते हैं और परीक्षण में बाधा उत्पन्न नहीं करते हैं।

प्रश्न 26.
N, S तथा P के परीक्षण के लिये Na के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है ?
उत्तर:
कार्बनिक यौगिक में उपस्थित नाइट्रोजन, सल्फर तथा हैलोजन सहसंयोजी अवस्था में होते हैं। अत: इनकी पहचान करना सरल नहीं है। धातु के साथ संगलन करने पर ये तत्व यूरिया या थायोयूरिया में बदल जाते हैं अर्थात् आयनिक रूप में बदल जाते हैं। आयनिक अवस्था में ये तत्व सरलता से आयनिक अभिक्रियाओं द्वारा पहचान लिये जाते हैं।
![]()
प्रश्न 27.
CaSO4 तथा कपूर के मिश्रण के अवयवों को पृथक् करने के लिए एक उपयुक्त तकनीक बताइए।
उत्तर:
CaSO4 तथा कपूर के मिश्रण को ऊर्ध्वपातन तकनीक द्वारा पृथक् करते हैं क्योंकि कपूर ऊर्ध्वपातन है, जबकि CaSO4 नहीं। अतः मिश्रण को गर्म करने पर कपूर फनल की दीवारों पर एकत्रित होगा तथा CaSO4 क्रूसिबल में ही रह जायेगा।
प्रश्न 28.
भाप आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत क्यों हो जाता है ?
उत्तर:
भाप आसवन विधि में, कार्बनिक द्रव तथा जल का मिश्रण कार्बनिक द्रव के वाष्प दाब (P1) तथा जल के वाष्प दाब (P2) के योग के वायुमंडलीय दाब (P) के बराबर हो जाने पर उबलता है, अर्थात् P = P1 + P2 चूँकि P की अपेक्षा P1 निम्न रहता है। अतः कार्बनिक द्रव अपने क्वथनांक से पूर्व ही निम्न ताप पर उबलने लगता है।
प्रश्न 29.
क्या CCl4 AgNO3 के साथ गर्म करने पर AgCl का सफेद अवक्षेप नहीं देता? कारण सहित समझाइए।
उत्तर:
CCl4, AgNO3 विलयन के साथ सफेद अवक्षेप नहीं देगा क्योंकि CCl4 एक सहसंयोजी यौगिक है। यह आयनित नही होता है, जिनके कारण AgCl का अवक्षेप बनने के लिए Cl आयन प्राप्त नहीं होता है।
प्रश्न 30.
किसी कार्बनिक यौगिक में C का आकलन करते समय उत्पन्न CO2 को अवशोषित करने के लिये KOH विलयन का उपयोग क्यों करते हैं ?
उत्तर:
KOH, CO2 गैस को अवशोषित कर K2CO3 (विलेय पदार्थ) में बदल जाता है।
2KOH + CO2 → K2CO3 + H2O(l)
प्रश्न 31.
लेड ऐसीटेट परीक्षण द्वारा S परीक्षण करते समय अम्ल के स्थान पर H2SO4 प्रयुक्त करना सलाह योग्य नहीं है। कारण बताइए।
उत्तर:
यदि H2SO4 का प्रयोग करते हैं तो लेड ऐसीटेट स्वयं H2SO4 के साथ क्रिया करके लेड सल्फेट का सफेद अवक्षेप देता है।
![]() अत: PbSO4 का सफेद अवक्षेप सल्फर के निम्नलिखित परीक्षण को प्रभावित करेगा –
अत: PbSO4 का सफेद अवक्षेप सल्फर के निम्नलिखित परीक्षण को प्रभावित करेगा –
![]()
परन्तु यदि ऐसिटिक अम्ल का प्रयोग किया जाये तो लेड ऐसीटेट के साथ क्रिया नहीं करता है, जिसके कारण यह परीक्षण में बाधा उत्पन्न नहीं करता है।
![]()
प्रश्न 32.
एक कार्बनिक यौगिक में 69% कार्बन एवं 4.8% हाइड्रोजन पाया जाता है तथा शेष ऑक्सीजन होता है। CO2 तथा उत्पादित जल के भारों की गणना कीजिए जब इस यौगिक का 0.20 g पूर्ण दहन में आरोपित किया जाता है।
हल:
![]()

प्रश्न 33.
0. 50 g कार्बनिक यौगिक को जेल्डॉलीकृत किया गया है। उत्पन्न अमोनिया को 1 N H2SO4 के 50 cm3में प्रवाहित किया गया। अवशेषी अम्ल को N/2 NaOH विलयन के 60 cm3 की आवश्यकता होती है। यौगिक में नाइट्रोजन की प्रतिशत गणना कीजिए।
हल:
लिए गए अम्ल का आयतन = 50 mL – 0.5 M H2SO4
= 25 mL 1.0 M H2SO4
अम्ल की अधिकता को उदासीन करने में प्रयुक्त क्षार का आयतन
= 60 mL 0.5 M NaOH
= 30 mL 1.0 M NaOH
H2SO4 + 2NaOH + Na2SO4 + 2H2O
1 मोल H2SO 1 मोल NaOH
30 mL 1.0 M NaO H = 15 mL 1.OM H2SO4
अमोनिया द्वारा प्रयुक्त अम्ल का आयतन = 25 – 15 = 10mL

प्रश्न 34.
केरियस आकलन में 0.3780g कार्बनिक क्लोरो यौगिक से 0-5740g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में Cl की % ज्ञात कीजिए।
हल:
![]()
प्रश्न 35.
केरियस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फर युक्त कार्बनिक यौगिक से 0.668g BaSO प्राप्त हुआ। दिये गये कार्बन यौगिक में सल्फर के % की गणना कीजिए।
हल:
प्रश्नानुसार, दिए गए कार्बनिक यौगिक का द्रव्यमान = 0.468g
उत्पन्न BasO4 का द्रव्यमान = 0.668g

प्रश्न 36.
![]()
कार्बनिक यौगिक में C2 – C3आबन्ध किन संकरित कक्षकों के युग्म से निर्मित होता है ?
उत्तर:
![]()
C2 – C3 आबन्ध sp2 – sp3 संकरित कक्षकों के युग्म से निर्मित होता है।
![]()
प्रश्न 37.
किसी कार्बनिक यौगिक में लैसेग्ने परीक्षण द्वारा नाइट्रोजन की जाँच में प्रशियन ब्लू रंग किसके कारण प्राप्त होता है ?
उत्तर;
Fe4 [Fe(CN)6]3यौगिक बनने के कारण।
प्रश्न 38.
निम्नलिखित कार्ब-धनायनों में से कौन-सा सबसे अधिक स्थायी है –

उत्तर:
(b) (CH3)3 \($C$ \) (तृतीयक कार्ब-धनायन होने के कारण)।
प्रश्न 39.
कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वोत्तम तथा आधुनिकतम तकनीक कौन-सी है
(a) क्रिस्टलन
(b) आसवन
(c) ऊर्ध्वपातन
(d) क्रोमैटोग्राफी।
उत्तर:
(d) क्रोमैटोग्राफी।
प्रश्न 40.
CH3 – CH2I + KOH(aq) → CH3CH2OH + KI अभिक्रिया को नीचे दिये गये प्रकार में,वर्गीकृत कीजिए –
(a) इलेक्ट्रॉन स्नेही प्रतिस्थापन
(b) नाभिक स्नेही प्रतिस्थापन
(c) विलोपन
(d) संकलन।
उत्तर:
(b) नाभिक स्नेही प्रतिस्थापन अभिक्रिया।
![]()
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें अन्य महत्वपूर्ण प्रश्न
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सही विकल्प चुनकर लिखिए –
1. एलिचक्रीय यौगिक है –
(a) ऐरोमैटिक यौगिक
(b) ऐलिफैटिक यौगिक
(c) विषमचक्रीय यौगिक
(d) ऐलिफैटिक चक्रीय यौगिक।
उत्तर:
(d) ऐलिफैटिक चक्रीय यौगिक।
2. एल्काइन का सामान्य सूत्र है –
(a) CnH2n+2
(b) CnH2n+1
(c)CnH2n
(d) CnH2n-2
उत्तर:
(d) CnH2n-2
3. IUPAC पद्धति से (CHF). CH – CH = CH – CH3 का नाम होगा –
(a) 2 – मेथिल पेन्टा – 3 – ईन
(b) 4 – मेथिल पेन्टा – 2 – ईन
(c) 2 – आइसो प्रोपिल प्रोप -1- ईन
(d) 3 – आइसो प्रोपिल प्रोप – 2 – ईन।
उत्तर:
(b) 4 – मेथिल पेन्टा – 2 – ईन
4. कार्बनिक यौगिकों का मुख्य स्रोत है –
(a) कोलतार
(b) पेट्रोलियम
(c) (a) और (b) दोनों
(d) इनमें से कोई नहीं।
उत्तर:
(c) (a) और (b) दोनों
5. ऐल्कोहॉल का सामान्य सूत्र है –
(a) CnH2n+2
(b) CnH2n+1.OH
(c) CnH2n-2
(d) CnH2n
उत्तर:
(b) CnH2n+1OH.
![]()
6. निम्नलिखित यौगिक परस्पर किस प्रकार की समावयवता प्रदर्शित करते हैं –
(a) केवल क्रियात्मक समूह
(b) केवल श्रृंखला
(c) स्थिति तथा श्रृंखला
(d) केवल स्थिति।
उत्तर:
(b) केवल श्रृंखला
7. निम्नलिखित में से कौन एक कार्बएनायन का उदाहरण है –
(a) CH–3
(b) \($$: \mathrm{CH}_{3}$$\)
(c) \($\stackrel{\oplus}{\mathrm{C}} \mathrm{H}_{3}$\)
(d) CH3
उत्तर:
(b) \($$: \mathrm{CH}_{3}$$\)
8. किरेल अणु उनको कहते हैं –
(a) जो अपने दर्पण प्रतिबिम्ब पर अध्यारोपित नहीं होते हैं
(b) जो अपने दर्पण प्रतिबिम्ब पर अध्यारोपित होते हैं
(c) जो ज्यामिति समावयवता दर्शाते हैं
(d) जो स्थायी अणु होते हैं।
उत्तर:
(a) जो अपने दर्पण प्रतिबिम्ब पर अध्यारोपित नहीं होते हैं
9. निम्न में से किसमें तीनों समूह -I प्रभाव प्रदर्शित करते हैं –
(a) -NO2 , -Br, -CH3
(b) -I, -NO2, -C2H5
(c) – Cl, – C2H5, – CH3
(d) -F, -NO2, -C6H5.
उत्तर:
(d) -F, -NO2, -C6H5
10. नाभिकस्नेही का उदाहरण निम्न में से है –
(a) F– आयन
(b) H2O+ आयन
(c) Cl परमाणु .
(d) एनीलीन हाइड्रोक्लोराइड।
उत्तर:
(a) F आयन
![]()
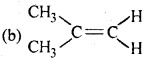
11. निम्नलिखित में से कौन-सा यौगिक ज्यामितीय समावयवी रूपों में पाया जा सकता है –
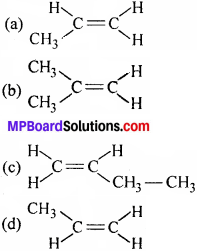
उत्तर:
12. एक पदार्थ का एक से अधिक ठोस रूपान्तरों में अस्तित्व रखना ……………. जाना जाता है –
(a) बहुरूपता
(b) समाकृतिकता
(c) अपरूपता
(d) प्रतिबिम्बरूपता।
उत्तर:
(a) बहुरूपता
13. Cl.CH2CH2COOH की संरचना वाले यौगिक का नाम है –
(a) 3 – क्लोरोप्रोपेनोइक अम्ल
(b) 2 – क्लोरोप्रोपेनोइक अम्ल
(c) 2 – क्लोरोएथेनोइक अम्ल
(d) क्लोरोसक्सिनिक अम्ल।
उत्तर:
(a) 3 – क्लोरोप्रोपेनोइक अम्ल
14. आइसोब्यूटिल क्लोराइड का संरचना सूत्र है –
(a) CH3CH2CH2CH2Cl
(b) (CH3)2CH.CH2Cl
(c) CH3CH2CHCl.CH3
(d) (CH3)3C – Cl.
उत्तर:
(c) CH3CH2CHCl.CH3
15. CnH2n सामान्य सूत्र है –
(a) ऐल्केन्स का
(b) ऐल्कीन्स का
(c) ऐल्काइन्स का
(d) ऐरीन्स का।
उत्तर:
(b) ऐल्कीन्स का
![]()
16. कार्बन टेट्राक्लोराइड में बन्ध कोण है लगभग –
(a) 90°
(b) 109°
(c) 120°
(d) 180°
उत्तर:
(b) 109°
17. (CH3)2CH – O – CH2 – CH2 – CH3 का नाम है –
(a) आइसोप्रोपिल प्रोपिल ईथर
(b) डाइप्रोपिल ईथर
(c) डाइआइसो प्रोपिल ईथर
(d) आइसोप्रोपिल प्रोपिलकीटोन।
उत्तर:
(a) आइसोप्रोपिल प्रोपिल ईथर
18. कैल्सियम कार्बाइड पर जल की क्रिया द्वारा यह गैस उत्पन्न होती है –
(a) मेथेन
(b) एथेन
(c) एथिलीन
(d) ऐसीटिलीन।
उत्तर:
(d) ऐसीटिलीन।
19. बेयर अभिकर्मक है –
(a) क्षारीय KMnO4
(b) अमोनियामय AgNO3
(c) अमोनियामय CuSO4
(d) अप्लीय CaSO4
उत्तर:
(a) क्षारीय KMnO4
20. Cl3C.CH2CHO सूत्र वाले यौगिक का IUPAC नाम है –
(a) 3, 3, 3-ट्राइक्लोरोप्रोपेनल
(b) 1,1, 1-ट्राइक्लोरोप्रोपेनल
(c) 2, 2, 2-ट्राइक्लोरोप्रोपेनल
(d) क्लोरल।
उत्तर:
(a) 3, 3, 3-ट्राइक्लोरोप्रोपेनल
![]()
21. त्रिविम समावयवी भिन्न होते हैं –
(a) विन्यास में
(b) संरूपण में
(c) ये भिन्न नहीं होते
(d) इनमें से कोई नहीं।
उत्तर:
(a) विन्यास में
22. CH3– CH – (OH) – COOH प्रदर्शित करता है –
(a) ज्यामितीय समावयवता
(b) प्रकाशीय समावयवता
(c) (a) और (b) दोनों
(d) इनमें से कोई नहीं।
उत्तर:
(b) प्रकाशीय समावयवता
23. नाइट्रो एथेन निम्न में से एक प्रकार की समावयवता है –
(a) मध्यावयवता
(b) प्रकाश सक्रियता
(c) चलावयवता
(d) स्थान समावयवता।
उत्तर:
(c) चलावयवता
![]()
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिए –
- फ्रिऑन कार्बनिक पदार्थ जिसका उपयोग वायु प्रशीतकों तथा रेफ्रीजरेटर्स में होता है का रासायनिक नाम ……………. एवं संरचना सूत्र ……………… होगा।
- दो पदार्थों को पृथक् करने की प्रभाजी क्रिस्टलन विधि ……………. के अन्तर पर निर्भर करती है।
- कार्बनिक यौगिक में उपस्थित हैलोजन की मात्रा ज्ञात करते हैं उसे ……………… में बदलकर।
- एक पदार्थ में 80% कार्बन तथा 20% हाइड्रोजन है तो उसका सूत्र ………………. होगा।
- मार्श गैस में मुख्यतः ……………. गैस होती है।
- ‘भिन्न-भिन्न अवशोषण दर से अलग किए गये पदार्थ का प्रक्रम ……………. कहलाता है।
- जेल्डॉल विधि का प्रयोग ……………. तल के आकलन में होता है।
- दो पदार्थों के मिश्रण का पृथक्करण ……………. पर निर्भर करता है।
- o-नाइट्रोफिनॉल और p-नाइट्रोफिनॉल के मिश्रण का पृथक्करण ……………. से होता है।
- ग्लिसरीन के क्वथनांक पर वियोजन होता है, यह शुद्धिकरण ……………. से होता है।
उत्तर:
- डाइफ्लुओरो – डाइक्लोरो मेथेन, CF2Cl2
- विलायक
- सिल्वर हैलाइड
- C2H6.
- मेथेन
- इल्युशन
- नाइट्रोजन
- विलेयता
- भाप आसवन
- निम्न दाब आसवन
![]()
प्रश्न 3.
उचित संबंध जोडिए –
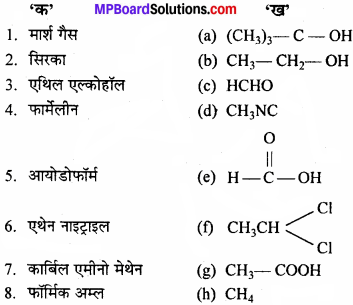
उत्तर:
- (h) CH4
- (g) CH3 – COOH
- (b) CH3 – CH2 – OH
- (c) HCHO
- (i) CHI3
- (j) CH3 – CN
- (d) CH3NC
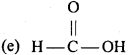
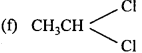
- (a) (CH3)3 – C – OH
![]()
प्रश्न 4.
एक शब्द / वाक्य में उत्तर दीजिए –
- CH3 – CH2 CHCl – CH3 का रासायनिक नाम है …………..।
- KMnO4 और KOH का मिश्रण कहलाता है।
- सिरका का IUPAC नाम है।
- अन्न एल्कोहॉल का IUPAC नाम है।
- CaSO4 युक्त मिश्रण में कपूर को अलग किया जाता है।
- नैफ्थेलीन का शुद्धिकरण होता है।
- कॉलम क्रोमैटोग्राफी द्वारा शुद्धिकरण होता है क्योंकि –
- पेट्रोलियम का शुद्धिकरण होता है।
- बेलस्टाइन परीक्षण का प्रयोग होता है।
- मुक्त मूलक आबंधन के किस प्रकार के विदलन से बनते हैं।
उत्तर:
- आइसो ब्यूटिल क्लोराइड
- बेयर अभिकर्मक
- एथेनोइक अम्ल
- एथेनॉल
- ऊर्ध्वपातन
- ऊर्ध्वपातन
- अलग-अलग अवशोषण
- प्रभाजी आसवन
- हैलोजन परीक्षण में
- समांश विदलन से।
![]()
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें अति लघु उत्तरीय प्रश्न
प्रश्न 1.
समावयवता किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
वे यौगिक जिनके अणुसूत्र समान होते हैं लेकिन संरचना सूत्र भिन्न-भिन्न होते हैं ये एक-दूसरे के समावयवी कहलाते हैं तथा इस गुण को समावयवता कहते हैं। उदाहरण – एथिल ऐल्कोहॉल C2H5OH और डाइमेथिल ईथर के अणुसूत्र C2H6O समान हैं, लेकिन इनके संरचना सूत्र में भिन्नता है इसलिये ये एक-दूसरे के समावयवी हैं।
प्रश्न 2.
स्थान समावयवता को उदाहरण सहित समझाइये।
उत्तर:
इस प्रकार की समावयवता तब होती है जब प्रतिस्थापी मूलक या क्रियात्मक समूह या द्विबंध या त्रिबंध की भिन्न-भिन्न स्थितियाँ हों अर्थात् भिन्न-भिन्न C पर जुड़े हों।
उदाहरण:
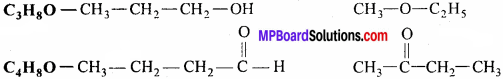
C3H8O
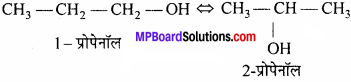
प्रश्न 3.
C3H6O अणुसूत्र वाले दो क्रियात्मक समावयवी यौगिकों के संरचना सूत्र और प्रचलित नाम लिखिये।
उत्तर:

प्रश्न 4.
पेण्टेन के समावयवी लिखिये तथा उपस्थित समावयवता का नाम लिखिये।
अथवा
एल्केन में किस प्रकार की समावयवता होती है ? उदाहरण सहित स्पष्ट कीजिये।
उत्तर:
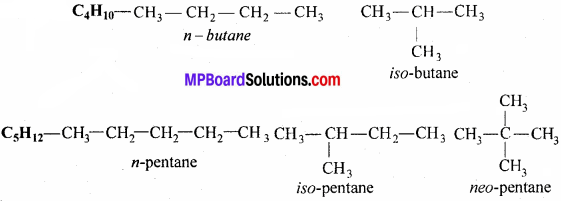
एल्केन सामान्यतः शृंखला समावयवता दर्शाते हैं, उदाहरण के रूप में – C5H12 में शृंखला समावयवता होती है, इसके तीन समावयवी बनते हैं-
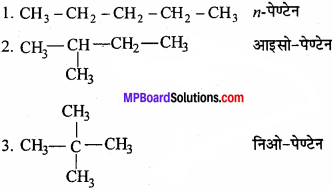
प्रश्न 5.
एल्काइन में श्रृंखला एवं स्थिति समावयवता को उदाहरण सहित समझाइये।
उत्तर:
एल्काइन शृंखला एवं स्थिति समावयवंता दर्शाते हैं।
1. श्रृंखला समावयवता –

2. स्थिति समावयवता –
![]()
प्रश्न 6.
एरीन में कौन-सी समावयवता पायी जाती है ? उदाहरण दीजिये।
उत्तर:
एरीन में स्थान समावयवता होती है।
उदाहरण –
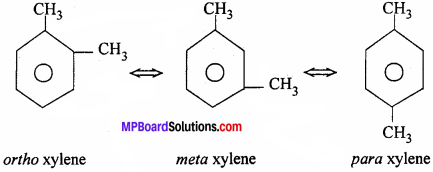
प्रश्न 7.
निम्नलिखित यौगिकों के संरचना सूत्र दिये गये हैं। इनमें पायी जाने वाली समावयवता के नाम लिखिये
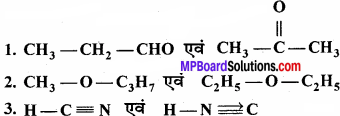
उत्तर:
- क्रियात्मक समावयवता
- मध्यावयवता
- चलावयवता।
प्रश्न 8.
कार्बनिक यौगिकों में C व H के आकलन की विधि का नाम लिखिये।
उत्तर:
कार्बनिक यौगिकों में C व H के आकलन के लिये लीबिग विधि का प्रयोग करते हैं।
![]()
प्रश्न 9.
निम्नलिखित मिश्रणों को शुद्ध करने की विधि का नाम लिखिये –
- अशुद्ध नैफ्थेलीन
- दो वाष्पशील द्रव
- आयोडीन व NaCl
- बेंजीन एवं टॉलुईन।
उत्तर:
- अशुद्ध नैफ्थेलीन – ऊर्ध्वपातन
- दो वाष्पशील द्रव – प्रभाजी आसवन
- आयोडीन व NaCl – ऊर्ध्वपातन
- बेंजीन एवं टॉलुईन – प्रभाजी आसवन।
प्रश्न 10.
कार्बनिक यौगिकों के शोधन में प्रयुक्त होने वाली विधियों के नाम लिखिये।
उत्तर:
- ठोस पदार्थ के लिये प्रयुक्त होने वाली विधि – साधारण क्रिस्टलन, प्रभाजी क्रिस्टलन, ऊर्ध्वपातन तथा विलायकों द्वारा निष्कर्षण।
- द्रव पदार्थ के लिये प्रयुक्त होने वाली विधि – साधारण आसवन, प्रभाजी आसवन, निर्वात आसवन, भाप आसवन इत्यादि।
प्रश्न 11.
क्रोमैटोग्राफी किसे कहते हैं ?
उत्तर:
किसी मिश्रण के विभिन्न अवयवों को किसी अधिशोषक पर अधिशोषित होने की शक्ति में भिन्नता के आधार पर स्थिर व चलायमान प्रावस्थाओं में वितरित कर पृथक करने की प्रक्रिया क्रोमैटोग्राफी कहलाती है।
प्रश्न 12.
यदि कोई कार्बनिक पदार्थ बहुत थोड़ी मात्रा में दिया गया है तो उसकी शुद्धता की जाँच किस प्रकार की जाती है ?
उत्तर:
यदि कोई पदार्थ बहुत कम मात्रा में दिया गया है तो उसकी शुद्धता उसके गलनांक या क्वथनांक को ज्ञात करके की जा सकती है या फिर शुद्धता का परीक्षण स्तम्भ क्रोमैटोग्राफी से करते हैं यदि एक बैण्ड प्राप्त होता है तो यौगिक शुद्ध होगा और यदि एक से अधिक बैण्ड प्राप्त होते हैं तो यौगिक अशुद्ध होगा।
प्रश्न 13.
अधिशोषण वर्णलेखी प्रक्रम का कार्बनिक यौगिकों के शोधन में क्या उपयोग है ? लिखिये।
उत्तर:
अधिशोषण वर्णलेखी प्रक्रम का उपयोग विशेषतः विटामिन और हॉर्मोन्स जैसे – जटिल यौगिकों के पृथक्करण में होता है तथा इसका उपयोग पदार्थों की शुद्धता का परीक्षण करने में होता है।
![]()
प्रश्न 14.
कार्बनिक यौगिक में हैलोजन का सिल्वर नाइट्रेट परीक्षण करते समय HNO3 मिलाते हैं, क्यों?
उत्तर:
यदि कार्बनिक यौगिक में हैलोजन के अतिरिक्त S तथा N उपस्थित हैं तो सोडियम निष्कर्ष में उपस्थित NaCN तथा Na2S, सिल्वर नाइट्रेट के साथ अभिक्रिया करके अवक्षेप देते हैं और हैलोजन के परीक्षण में बाधा उत्पन्न नहीं करते हैं। लेकिन सोडियम निष्कर्ष में सान्द्र HNO3 मिलाने से ये NaCN तथा Nags अपघटित हो जाते हैं और परीक्षण में बाधा उत्पन्न नहीं करते हैं।

प्रश्न 15.
नाइट्रोजन का परीक्षण करते समय FeCl3 का विलयन मिलाने पर रक्त लाल रंग का श्वेत अवक्षेप आता है। क्यों?
उत्तर:
नाइट्रोजन का परीक्षण करते समय FeCl3 मिलाने पर लाल रंग का उत्पन्न होना कार्बनिक यौगिक मैं N तथा S दोनों की उपस्थिति को दर्शाता है। क्योंकि सोडियम निष्कर्ष बनाते समय कार्बनिक यौगिक में उपस्थित N एवं S सोडियम के साथ अभिक्रिया करके सोडियम सल्फोसायनाइड बनाते हैं जो FeCl3 के साथ अभिक्रिया करके फैरिक सल्फोसायनाइड का रक्त लाल रंग का विलयन देते हैं।
Na + C + N + S →NaSCN
NaSCN + FeCl3 → Fe(CNS)3 + 3NaCl
प्रश्न 16.
आयतनात्मक विधि द्वारा किस प्रकार के यौगिकों के आण्विक द्रव्यमान को ज्ञात किया जा सकता है ?
उत्तर:
आयतनात्मक विधि द्वारा अम्लीय या क्षारीय गुण दर्शाने वाले यौगिक सूचक की उपस्थिति में मानक क्षार या मानक अम्ल द्वारा अनुमापन किया जाता है तथा अनुमापन द्वारा उनके तुल्यांकी भार को ज्ञात कर लेते हैं। मानक अम्ल या क्षार उनके तुल्यांकी भार को एक लीटर में विलेय करके बनाये जाते हैं। अम्ल या क्षार का आण्विक द्रव्यमान = तुल्यांकी द्रव्यमान × अम्लता या क्षारकता।
प्रश्न 17.
कार्बनिक यौगिकों के तत्वों के परीक्षण हेतु सोडियम निष्कर्ष क्यों बनाया जाता है ?
उत्तर:
कार्बनिक यौगिक सहसंयोजी प्रकृति के होने के कारण सरलता से आयनित नहीं होते हैं। जिसके कारण इनमें उपस्थित तत्वों का परीक्षण सरलता से नहीं किया जा सकता है। सोडियम एक अत्यन्त क्रियाशील धातु है जो कार्बनिक यौगिक में उपस्थित तत्वों के साथ संयोग करके सोडियम यौगिक बनाता है जो प्रबल आयनिक होते हैं और सरलता से आयनित हो जाते हैं इसलिये तत्वों का परीक्षण सरलता से किया जा सकता है।
![]()
प्रश्न 18.
सोडियम निष्कर्ष में ब्रोमीन या आयोडीन का परीक्षण करने के लिये क्लोरोफॉर्म या CCI, क्यों मिलाया जाता है ?
उत्तर:
सोडियम निष्कर्ष को तनु HNO3 से उदासीन करके CHCl3 या CCl4 तथा क्लोरीन जल डालते हैं। क्लोरीन सोडियम निष्कर्ष में उपस्थित ब्रोमीन या आयोडीन को विस्थापित कर देता है, जो CHCl3 या CCl4 में विलेय होकर भूरा या बैंगनी रंग प्रदान करता है।
प्रश्न 19.
कार्बनिक यौगिक में कार्बन तथा हाइड्रोजन का परीक्षण किस प्रकार करते हैं ?
उत्तर:
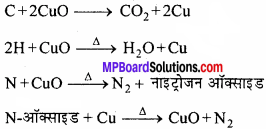
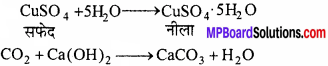
परखनली में शुष्क CuO के साथ कार्बनिक यौगिक को लेकर गर्म करते हैं निकलने वाली CO2 गैस चूने के पानी को दूधिया कर देती है जबकि जल वाष्प बूंदों के रूप में संघनित हो जाती है। इस निर्जल CuSO4 द्वारा अवशोषित होने के कारण उसे नीला कर देती है।
C + 2 Cuo → CO2 + 2Cu
2H + CuO → H2O + Cu
प्रश्न 20.
किसी कार्बनिक यौगिकों के शुद्धता परीक्षण की मिश्रित गलनांक विधि से क्या समझते हो?
उत्तर:
पूर्णरूप से मिले हुये दो पदार्थों के मिश्रण को मिश्रित गलनांक कहते हैं। इस विधि में पदार्थ की शुद्धता की जाँच करने के लिये दिये गये पदार्थ को विशुद्ध पदार्थ की समान मात्रा के साथ मिश्रित करके मिश्रण का गलनांक ज्ञात करते हैं। यदि मिश्रण का गलनांक शुद्ध पदार्थ के गलनांक के समान है तो दिया गया पदार्थ शुद्ध है।
प्रश्न 21.
दो भिन्न क्वथनांक वाले द्रवों का पृथक्करण किस प्रकार किया जा सकता है ?
उत्तर:
दो द्रव जिनके क्वथनांक में अंतर हो का पृथक्करण प्रभाजी आसवन विधि द्वारा करते हैं। अधिक वाष्पशील यौगिक पहले वाष्पित होता है तथा इसकी वाष्प प्रभाजी स्तम्भ से आगे बढ़कर संघनित्र में से प्रवाहित होने पर द्रवित होकर ग्राही में एकत्रित हो जाती है जबकि कम वाष्पशील पदार्थ की वाष्प प्रभाजी स्तम्भ में संघनित होकर वापस फ्लास्क में आ जाती है।
प्रश्न 22.
मूलानुपाती सूत्र क्या है ?
उत्तर:
वह रासायनिक सूत्र जो यौगिक में उपस्थित विभिन्न तत्वों के परमाणुओं का सरलतम अनुपात दर्शाता है, मूलानुपाती सूत्र कहलाता है। उदाहरण- ग्लूकोस का मूलानुपाती सूत्र CH2O है।
![]()
प्रश्न 23.
अणुसूत्र क्या है ? उदाहरण सहित समझाइये।
उत्तर:
वह रासायनिक सूत्र जो यौगिक में उपस्थित विभिन्न तत्वों के परमाणुओं की वास्तविक संख्या को दर्शाता है, अणुसूत्र कहलाता है। उदाहरण- ग्लूकोस का अणुसूत्र C6 o H12O6 है।

प्रश्न 24.
विषम चक्रीय यौगिक किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
इस श्रेणी में वे चक्रीय यौगिक होते हैं जिनके चक्र में कार्बन परमाणु के अतिरिक्त एक या एक से अधिक बहु संयोजक परमाणु जैसे-नाइट्रोजन, सल्फर, ऑक्सीजन इत्यादि होते हैं।
- पिरीडीन C5 H5 N,
- C4 H4 O प्यूरेन
- थायोफिन C4 H4 S.
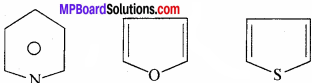
प्रश्न 25.
समचक्रीय यौगिक किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
इस श्रेणी में कार्बनिक यौगिक होते हैं जिनके चक्र में केवल कार्बन परमाणु होते हैं। समचक्रीय यौगिक दो प्रकार के होते हैं
- एरोमैटिक यौगिक
- एलीसाइक्लिक यौगिक।
उदाहरण:
एरोमैटिक यौगिक –
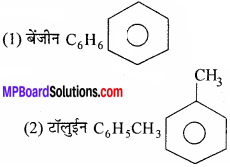
एलीसाइक्लिक यौगिक –
प्रश्न 26.
क्रियात्मक समूह किसे कहते हैं?
उत्तर:
सामान्यतः कार्बनिक यौगिक दो भागों से मिलकर बना होता है –
- मूलक
- क्रियात्मक समूह।
क्रियात्मक समूह – किसी कार्बनिक यौगिक का वह भाग जो उसके रासायनिक गुणों का निर्धारण करता है, क्रियात्मक समूह कहलाता है।
उदाहरण – C2H2 – OH में OH क्रियात्मक समूह है।
![]()
प्रश्न 27.
एल्डिहाइड श्रेणी का सामान्य सूत्र, अणुसूत्र लिखिये तथा प्रथम सजातों का साधारण नाम व IUPAC नाम लिखिये।
उत्तर:
1. सामान्य सूत्र – R – CHO
2. अणुसूत्र – Cn H2nO
3. H – CHO – फॉर्मेल्डिहाइड – Methanal
CH3 – CHO – एसीटैल्डिहाइड – Ethanal
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें लघु उत्तरीय प्रश्न
प्रश्न 1.
सल्फर के लेड ऐसीटेट द्वारा परीक्षण में सोडियम संगलन निष्कर्ष को ऐसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा, क्यों?
उत्तर;
यदि H2SO4 का प्रयोग करते हैं तो लेड ऐसीटेट स्वयं H2SO4 के साथ क्रिया करके लेंड सल्फेट का सफेद अवक्षेप देता है।
![]()
अत: PbSO4 का सफेद अवक्षेप सल्फर के निम्नलिखित परीक्षण को प्रभावित करेगा।
![]()
परन्तु यदि ऐसीटिक अम्ल का प्रयोग किया जाये तो लेड ऐसीटेट के साथ क्रिया नहीं करता है, जिसके कारण यह परीक्षण में बाधा उत्पन्न नहीं करता है।
प्रश्न 2.
किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइऑक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है ?
उत्तर:
CO2 की प्रकृति थोड़ी अम्लीय होती है। अत: यह प्रबल क्षार KOH के साथ क्रिया करके K2CO3 बनाती है। जिसकी सहायता से प्राप्त CO2 कार्बनिक यौगिक में कार्बन की प्रतिशत मात्रा ज्ञात कर ली जाती है।
2KOH + CO2 →K2CO3 + H2O
KOH वाली U – ट्यूब के भार में वृद्धि के फलस्वरूप उत्पन्न CO2 का भार ज्ञात करते हैं। प्राप्त CO2 के भार से कार्बनिक यौगिक में उपस्थित कार्बन की प्रतिशत मात्रा निम्न प्रकार से ज्ञात करते हैं।
![]()
प्रश्न 3.
इलेक्ट्रॉनस्नेही तथा नाभिकस्नेही अभिकर्मक में अंतर लिखिये।
उत्तर:
इलेक्ट्रॉनस्नेही तथा नाभिकस्नेही अभिकर्मक में अंतर –
इलेक्ट्रॉनस्नेही अभिकर्मक:
- इलेक्ट्रॉन न्यून होता है।
- सामान्यतः संयोजी कोश में इलेक्ट्रॉन होते हैं।
- ये धन विद्युती आयन होते हैं।
- उदासीन अणु जिनके अष्टक अपूर्ण होते हैं ये इलेक्ट्रॉन युग्म ग्राही होते हैं।
- लुईस अम्ल होते हैं।
- ये अणु के उस स्थान पर आक्रमण करते इलेक्ट्रॉन घनत्व न्यूनतम होता है।
नाभिकस्नेही अभिकर्मक:
- अधिक इलेक्ट्रॉन रखते हैं।
- सामान्यतः संयोजी कोश में 8 इलेक्ट्रॉन होते हैं। 109°28
- ये ऋण विद्युती आयन होते हैं।
- ये इलेक्ट्रॉन युग्म दाता होते हैं।
- लुईस क्षार होते हैं।
- ये उस स्थान पर आक्रमण करते हैं जहाँ हैं जहाँ इलेक्ट्रॉन घनत्व अधिकतम होता है।
प्रश्न 4.
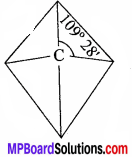
कार्बन परमाणु की संयोजकता संबंधी वाण्ट हॉफ तथा लेवेल का नियम समझाइये।
उत्तर:
कार्बन का परमाणु क्रमांक 6 है। इसका सामान्य इलेक्ट्रॉनिक विन्यास 2, 4 है। इस प्रकार इसके संयोजी कोश में 4 इलेक्ट्रॉन हैं इसलिये इसकी संयोजकता 4 है। वाण्ट हॉफ तथा लेवेल के अनुसार, कार्बन सामान्यत: sp3 संकरित होता है इसलिये इसकी संरचना समचतुष्फलकीय होती है। जिसमें कार्बन केन्द्र में स्थित रहता है तथा इसकी चारों संयोजकता चतुष्फलकीय संरचना के चारों कोनों में स्थित है और दो संयोजकताओं के बीच बंध कोण 109° 28′ होता है।
![]()
प्रश्न 5.
कार्बन केवल सहसंयोजी यौगिक बनाता है, क्यों?
उत्तर:
कार्बन का परमाणु क्रमांक 6 है इसके संयोजी कोश में 4 इलेक्ट्रॉन हैं। इसे अष्टक पूर्ण करने के लिये4अतिरिक्त इलेक्ट्रॉन की आवश्यकता है।अतःकार्बन 4 इलेक्ट्रॉन या तो दान कर सकता है या ग्रहण कर सकता है या 4 इलेक्ट्रॉन का साझा कर सकता है लेकिन कार्बन के छोटे आकार के कारण इसकी आयनन ऊर्जा व इलेक्ट्रॉन बंधुता अत्यधिक उच्च होती है। अतः कार्बन का 4 इलेक्ट्रॉन का दान करना या ग्रहण करना संभव नहीं है, अतः कार्बन अपना अष्टक पूर्ण करने के लिये केवल अन्य परमाणुओं के साथ इलेक्ट्रॉन का साझा कर सकता है इसलिये वह केवल सहसंयोजी यौगिक बनाता है।
प्रश्न 6.
क्या कारण है कि कार्बन बहुत अधिक संख्या में यौगिक बनाता है ?
अथवा
कार्बन की अद्वितीय प्रकृति को समझाइये।
उत्तर:
कार्बनिक यौगिकों के अधिकता में पाये जाने के निम्नलिखित कारण हैं –
1. श्रृंखलन – किसी तत्व के दो या दो से अधिक परमाणुओं का सहसंयोजक बंध द्वारा श्रृंखला बनाने की प्रवृति को श्रृंखलन कहते हैं। कार्बन परमाणु में श्रृंखलन की प्रवृत्ति सबसे अधिक होती है।
2. कार्बन – कार्बन परमाणु के मध्य प्रबल बंध – कार्बन परमाणु का आकार अत्यन्त छोटा है। इससे कार्बन परमाणु के अर्धपूर्ण कक्षकों का अतिव्यापन अत्यधिक सरलता से अधिक सीमा में हो सकता है जिसके फलस्वरूप कार्बन-कार्बन के बीच बना बंध अत्यधिक दृढ़ तथा प्रबल होता है।
3. बहु आबंध बनाने की प्रवृत्ति – कार्बन परमाणु अपने छोटे आकार के कारण अन्य परमाणु जैसे C, H, O, N के साथ सरलता से संयोग कर द्विबंध या त्रिबंध बना सकता है।
4. समावयवता – जब दो या दो से अधिक यौगिकों के अणुसूत्र समान हो लेकिन उनके संरचना सूत्र में भिन्नता हो तो ऐसे यौगिकों को समावयवी कहते हैं तथा इस गुण को समावयवता कहते हैं। यह गुण कार्बन में अधिकतम है। इन्हीं उपर्युक्त गुणों के कारण कार्बन बहुत अधिक संख्या में यौगिकों का निर्माण करती है।
![]()
प्रश्न 7.
कार्बनिक तथा अकार्बनिक यौगिक में अंतर लिखिये।
उत्तर:
कार्बनिक तथा अकार्बनिक यौगिक में अंतर –
कार्बनिक यौगिक:
- कार्बन तथा कुछ अन्य तत्व जैसे – H, O, N, S, P इत्यादि के संयोग से बनते हैं।
- ये सहसंयोजी यौगिक होते हैं।
- ये वैद्युत अपघट्य नहीं हैं।
- इनके गलनांक और क्वथनांक कम होते हैं
- ये जल में अविलेय परन्तु कार्बनिक विलायकों में विलेय हैं।
- ये समावयवता दर्शाते हैं।
- इनकी अभिक्रियायें आण्विक तथा जटिल होती हैं तथा धीमी गति से होती हैं।
अकार्बनिक यौगिक:.
- ये यौगिक सभी तत्वों द्वारा बनाये जाते हैं।
- अधिकांश अकार्बनिक यौगिक वैद्युत संयोजी होते हैं। लेकिन कुछ यौगिक सहसंयोजी तथा उपसहसंयोजी भी होते हैं।
- ये वैद्युत अपघट्य हैं।
- इनके गलनांक और क्वथनांक उच्च होते हैं।
- ये जल में विलेय परन्तु कार्बनिक विलायकों में अविलेय है।
- ये समावयवता नहीं दर्शाते हैं।
- इनकी अभिक्रियायें आयनिक होती हैं तथा तीव्र गति से होती हैं।
प्रश्न 8.
सजातीय श्रेणी किसे कहते हैं ? इसकी विशेषतायें लिखिये।
उत्तर:
कार्बनिक यौगिकों की वह श्रेणी जिसमें सदस्यों में समान क्रियात्मक समूह उपस्थित हो तथा जिसके दो क्रमागत सदस्यों के अणुओं में CH2 का अंतर हो, सजातीय श्रेणी कहलाती है।
विशेषतायें –
- सजातीय श्रेणी के सदस्यों को एक सामान्य सूत्र द्वारा प्रदर्शित किया जा सकता है।
- श्रेणी के दो क्रमागत सदस्यों के अणुसूत्र में CH2 का अंतर होता है।
- श्रेणी के दो क्रमागत सदस्यों के अणुभार में 14 का अंतर होता है।
- श्रेणी के सभी सदस्यों को समान रासायनिक अभिक्रियाओं द्वारा बनाया जा सकता है।
- श्रेणी के सभी सदस्यों के रासायनिक गुणों में समानता होती है।
प्रश्न 9.
कार्बनिक यौगिकों में प्राथमिक, द्वितीयक, तृतीयक और चतुर्थक कार्बन क्या होते हैं ?
उत्तर:
प्राथमिक कार्बन – किसी कार्बनिक यौगिक में उपस्थित वह कार्बन परमाणु जो अधिकतम एक कार्बन परमाणु से जुड़ा है, प्राथमिक कार्बन या 1°C कार्बन कहलाता है। द्वितीयक कार्बन – किसी कार्बनिक यौगिक में उपस्थित वह कार्बन जो दो कार्बन परमाणु से जुड़ा है। द्वितीयक या 2°C कार्बन कहलाता है। बृतीयक कार्बन – किसी कार्बनिक यौगिक में उपस्थित वह कार्बन जो तीन अन्य कार्बन परमाणु से जुड़ा हो तृतीयक कार्बन या 3°C कहलाता है। चतुर्थक कार्बन – किसी कार्बनिक यौगिक में उपस्थित वह कार्बन जो अन्य 4 कार्बन परमाणु से जुड़ा हो चतुर्थक कार्बन कहलाता है।
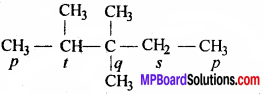
जहाँ p = प्राथमिक, s = द्वितीयक, t = तृतीयक, q= चतुर्थक।
प्रश्न 10.
अमोनियम क्लोराइड तथा सोडियम क्लोराइड के मिश्रण को पृथक् करने की विधि समझाइये।
अथवा
नैफ्थेलीन तथा नमक के मिश्रण को पृथक् करने की विधि को समझाइये।
उत्तर:
नौसादर (अमोनियम क्लोराइड) या नैफ्थेलीन तथा NaCl के मिश्रण को ऊर्ध्वपातन विधि द्वारा पृथक् करते हैं। इस मिश्रण को एक चीनी की प्याली में लेकर छिद्र युक्त फिल्टर पेपर से ढंक देते हैं तथा फनल की नली में रूई या ऊन भरकर फिल्टर पेपर के ऊपर उल्टा करके रख देते हैं तथा इसे बालू ऊष्मक पर रखकर धीरे-धीरे गर्म करते हैं। NH4Cl या नैफ्थेलीन ऊर्ध्वपातित होकर फिल्टर पेपर के छिद्रों से गुजरकर फनल की दीवारों के ठण्डे भाग में जमा हो जाते हैं जहाँ से इन्हें पृथक कर लेते हैं तथा नमक (NaCl) प्याली में शेष रह जाता है।
![]()
प्रश्न 11.
किसी कार्बनिक यौगिक में नाइट्रोजन का परीक्षण लैसग्ने विधि द्वारा कैसे किया जाता है ?
उत्तर:
नाइट्रोजन के परीक्षण की लैसग्ने विधि-कार्बनिक पदार्थ के सोडियम निष्कर्ष में थोड़ा-सा NaOH मिलाकर FeSO4 का ताजा बना विलयन मिलाकर गर्म करने पर Fe (OH)2 का हरा अवक्षेप बनता है। इसे ठण्डा कर सान्द्र HCl मिलाया जाता है। जिसमें हरा अवक्षेप विलेय हो जाता है फिर FeCl3 विलयन मिलाते हैं। नीला या हरा अवक्षेप प्राप्त हो तो यौगिक में नाइट्रोजन उपस्थित है।
Na + C + N → NaCN
Fe (OH)2 + 6 NaCN → Na4 [Fe(CN)6] + 2NaOH
3Na4 [Fe (CN)6] + 4 FeCl3 → Fe4 [ Fe (CN)6 ]3(नीला अवक्षेप) + 12NaCl
प्रश्न 12.
किसी कार्बनिक यौगिक में सल्फर का परीक्षण किस प्रकार किया जाता है ?.
उत्तर:
1. सोडियम नाइट्रोप्रुसाइड:
सोडियम निष्कर्ष में सोडियम नाइट्रो साइड की कुछ बूंदें मिलाने पर यदि बैंगनी रंग प्राप्त हो तो सल्फर उपस्थित होगा।

2. लेड एसीटेट परीक्षण सोडियम निष्कर्ष में एसीटिक अम्ल मिलाकर लेड एसीटेट मिलाने पर यदि काला अवक्षेप प्राप्त होता है तो कार्बनिक यौगिक में सल्फर उपस्थित है।

प्रश्न 13.
भाप आसवन किन यौगिकों के लिये उपयोगी है, सचित्र समझाइये।
उत्तर:
वे कार्बनिक यौगिक जो जल में अविलेय लेकिन भाप में वाष्पशील रूप में विलेय होते हैं, उनका शोधन भाप आसवन विधि द्वारा किया जाता है। अशुद्ध पदार्थ को एक गोल पेंदी वाले फ्लास्क में लेकर थोड़ासा जल मिलाते हैं। और इसे बालू ऊष्मक पर रखकर 90°C ताप पर गर्म करते हैं, तथा इसे वाष्प उत्पादक प्लास्क से जोड़कर इसमें वाष्प प्रवाहित करते है।
जो मिश्रण से वाष्पशील पदार्थ को अपने में विलेय करके वाष्प रूप में रहती है। इस वाष्प और वाष्पशील द्रव को संघनित से गुजार कर संघनित्र कर ग्राही में एकत्रित कर लेते हैं। यदि यौगिक अविलेय ठोस है तो उसे छानकर पृथक् कर लेते हैं और अविलेय द्रव है तो पृथक्कारी कीप की सहायता से छानकर पृथक् कर लेते हैं। एनिलीन तथा सुगन्धित तेलों का आसवन इस विधि द्वारा किया जाता है।
प्रश्न 14.
निर्वात् आसवन या कम दाब पर आसवन का सिद्धांत क्या है ? चित्र सहित समझाइये।
उत्तर:
ऐसे कार्बनिक यौगिक जो अपने क्वथनांक या उसके पूर्व ही गर्म करने पर अपघटित हो जाते हैं उनका शोधन निर्वात् आसवन द्वारा किया जाता है। ग्राही में निर्वात् पम्प द्वारा आंशिक निर्वात उत्पन्न करते हैं जिससे आसवन फ्लास्क में दाब कम हो जाता है। और द्रव अपने क्वथनांक से पूर्व ही उबलने लगता है। ग्लिसरॉल का शोधन इस विधि द्वारा करते हैं।
प्रश्न 15.
कार्बनिक यौगिक में उपस्थित हैलोजन का परीक्षण किस प्रकार किया जाता है ?
उत्तर:
AgNO3 परीक्षण-सोडियम निष्कर्ष में तनु HNO3 तथा AgNO3 मिलाने पर श्वेत अवक्षेप आये जो AgCl का होता है यदि श्वेत अवक्षेप NH4Cl के आधिक्य में विलेय हो तो कार्बनिक यौगिक में Cl उपस्थित होगा। सोडियम निष्कर्ष में तनु HNO3 तथा AgNO3 मिलाने पर हल्का पीला या गाढ़ा पीला अवक्षेप आये तो ब्रोमीन तथा आयोडीन उपस्थित होगा AgBr का हल्का पीला अवक्षेप NH4OH के आधिक्य में अल्प विलेय तथा AgI का गाढ़ा पीला अवक्षेप NH4OH के आधिक्य में अविलेय होगा।
प्रश्न 16.
कार्बनिक पदार्थ में उपस्थित सल्फर के आकलन की केरियस विधि का चित्र सहित वर्णन कीजिये।
उत्तर:
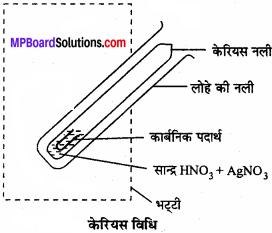
केरियस विधि:
सल्फर युक्त कार्बनिक यौगिक की निश्चित मात्रा को सधूम HNO3 के साथ गर्म करने पर सल्फर केरियस H3SO4 में ऑक्सीकृत हो जाता है। अभिक्रिया पूर्ण होने पर नली नली को ठण्डा करके H2SO4 को बीकर में लेकर आसुत जल से धोकर लोहे की इसमें BaCl2 विलयन की उचित मात्रा मिलाने पर BaSO4काश्वेत अवक्षेप आता है जिसे छानकर सुखा लेते हैं तथा इसका भार ज्ञात कर लेते हैं।

प्रश्न 17.
किसी कार्बनिक यौगिक हैलोजन का आकलन किस प्रकार किया जाता है ?
उत्तर:
केरियस विधि;
कार्बनिक यौगिक की – निश्चित मात्रा को सधूम HNO3 तथा AgNO4 के साथ एक। बंद नली में उच्च ताप पर गर्म करते हैं। केरियस नली इस प्रकार हैलोजन सिल्वर हैलाइड में परिवर्तित हो लोहे की नली जाता है। इस प्रकार प्राप्त Agx अवक्षेप को धोकर सुखाकर तौल लेते हैं। इसद्रव्यमान की सहायता से हैलोजन की प्रतिशत कार्बनिक पदार्थ मात्रा ज्ञात कर लेते हैं।
प्रश्न 18.
जेल्डॉल विधि द्वारा नाइट्रोजन का आकलन करने का सिद्धांत समझाइये।
उत्तर:
जेल्डॉल विधि का सिद्धांत:
जब नाइट्रोजन युक्त कार्बनिक पदार्थ की ज्ञात मात्रा लेकर उसे सान्द्र H2SO4 के साथ गर्म करते हैं तो कार्बनिक यौगिक में उपस्थित नाइट्रोजन, अमोनियम सल्फेट में परिवर्तित हो जाती है। इसे NaOH के साथ गर्म करने पर NH3 गैस बनती है। इस NH3 गैस को मानक अम्ल जैसे H2SO4 के ज्ञात आयतन में अवशोषित कर लेते हैं । प्रयोग के पश्चात् H2SO4 का मानक क्षार के साथ अनुमापन कर अमोनिया की बची मात्रा का परिकलन कर लेते हैं। इस मात्रा से कार्बनिक पदार्थ में नाइट्रोजन की % मात्रा को ज्ञात किया जा सकता है।
प्रश्न 19.
यौगिकों के शोधन की आसवन विधि को चित्र सहित समझाइये।
उत्तर:
किसी द्रव या ठोस पदार्थ को वाष्प में बदलकर दूसरे स्थान पर भेजकर उसे फिर से ठण्डा कर ठोस या द्रव अवस्था में प्राप्त करने की क्रिया को आसवन कहते हैं। आसवन अनेक प्रकार के होते हैं
- साधारण आसवन
- प्रभाजी आसवन
- निर्वात आसवन
- भाप आसवन।
साधारण आसवन:
यदि किसी द्रव में अवाष्पशील पदार्थों की अशुद्धि हो तो इस विधि का उपयोग किया जाता है। इस विधि द्वारा ऐसे द्रवों को पृथक् किया जाता है जिनके क्वथनांक में 30-40°C का अंतर है। मिश्रण को गर्म करने पर शुद्ध द्रव की वाष्प प्राप्त होती है जो संघनित्र द्वारा ठण्डी होकर ग्राही में एकत्रित हो जाती है तथा अशुद्धियाँ आसवन फ्लास्क में रह जाती हैं।
प्रश्न 20.
अधिशोषण क्रोमैटोग्राफी का सिद्धांत क्या है ? समझाइये।
उत्तर:
किसी मिश्रण के विभिन्न अवयवों की विलायक पथक्करण निरंतर इल्यूजन किसी अधिशोषक पर अधिशोषित होने की शक्ति में भिन्नता। होने के सिद्धांत पर यह विधि आधारित है। इसलिये जब एक काँच की नली में भरे हुये अधिशोषक पर किसी मिश्रण के विलयन कोडालकर नीचे बहने दियाजायेतोअधिशोषक शक्ति में भिन्नता होने के कारण मिश्रण के विभिन्न अवयव अधिशोषक में अलग-अलग स्थान पर अधिशोषित हो जाते हैं । जिनकी अधिशोषित होने की प्रवृत्ति अधिक होती है वे पहले अधिशोषित होते हैं तथा जिनकी अधिशोषित होने – की प्रवृत्ति कम होती है वे बाद में अधिशोषित होते हैं। इसे क्रोमैटोग्राफ कहा जाता है।
प्रश्न 21.
श्रृंखला समावयवता तथा क्रियात्मक समावयवता को उदाहरण सहित समझाइये। प्रथम घटक
उत्तर:
श्रृंखला समावयवता:
जब दो या दो से अधिक यौगिकों के अणुसूत्र समान हों लेकिन श्रृंखला में कार्बन परमाणुओं के व्यवस्थित होने के क्रम में भिन्नता हो तो इन यौगिकों को श्रृंखला समावयवी तथा इस गुण को श्रृंखला समावयवता कहते हैं।
उदाहरण –
क्रियात्मक समावयवता:
जब दो या दो से अधिक यौगिकों के अणुसूत्र समान हों लेकिन उनमें उपस्थित क्रियात्मक समूह भिन्न-भिन्न हों तो ऐसे यौगिक क्रियात्मक समावयवी तथा इस समावयवता को क्रियात्मक समावयवता कहते हैं।
प्रश्न 22.
निम्नलिखित के संघनित और आबंध-रेखा-सूत्र लिखिए तथा उनमें यदि कोई क्रियात्मक समूह हो, तो उसे पहचानिए
(a) 2,2,4-ट्राइमेथिलपेन्टेन
(b) 2,- हाइड्रॉक्सी-1, 2, 3- प्रोपेनट्राइकार्बोक्सिलिक अम्ल
(c) हेक्सेनडाऐल।
उत्तर:
संघनित और आबंध रेखा-सूत्र लिखने के लिए सर्वप्रथम दिए गए यौगिकों का संरचनात्मक सूत्र लिखते हैं –
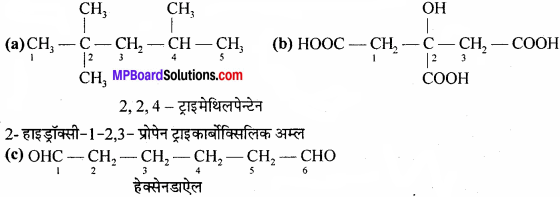
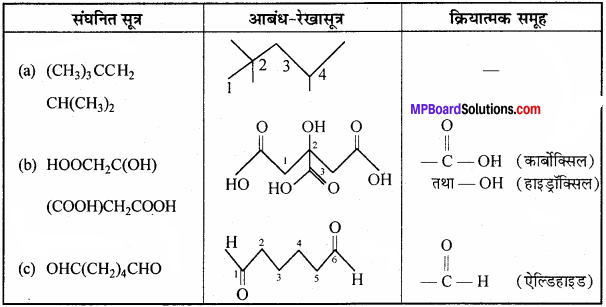
प्रश्न 23.
कार्बऋणायन या कार्बेनियन पर संक्षिप्त टिप्पणी लिखिये।
उत्तर:
कार्बेनियन:
वह ऋणावेशित आयन जिसमें ऋण आवेश C पर होता है, कार्बेनियन आयन कहलाता है। इनमें C के संयोजी कोश में 8 इलेक्ट्रॉन होते हैं। जिसमें तीन बंधी इलेक्ट्रॉन युग्म के रूप में तथा एक एकांकी इलेक्ट्रॉन युग्म के रूप में होता है।
वर्गीकरण:
प्राथमिक कार्बेनियन आयन – यदि ऋण आवेश प्राथमिक C पर होता है।
![]()
द्वितीयक कार्बेनियन आयन-ऋण आवेश द्वितीयक C पर होता है।

तृतीयक कार्बेनियन आयन-ऋण आवेश तृतीयक C पर होता है।

स्थायित्व:
कार्बेनियन आयन में C पर उपस्थित ऋण आवेश में वृद्धि होने पर स्थायित्व में कमी आती है। एल्किल मूलकों की संख्या में वृद्धि करने पर स्थायित्व में कमी आती है।
CH5 > 1° > 2° > 3°
संरचना:
इसमें कार्बन sp3 संकरित अवस्था में होता है, तीन आबंधी इलेक्ट्रॉन युग्म तथा एक एकांकी इलेक्ट्रॉन युग्म होता है।

प्रश्न 24.
मध्यावयवता तथा चलावयवता समावयवता को उदाहरण सहित समझाइये।
उत्तर:
मध्यावयवता:
जब दो या दो से अधिक यौगिकों के अणुसूत्र समान हों उनमें उपस्थित क्रियात्मक समूह भी समान हो लेकिन उनसे जुड़े एल्किल मूलक में भिन्नता हो तो इस प्रकार उत्पन्न समावयवता को मध्यावयवता कहते हैं।
चलावयवता:
यह एक विशेष प्रकार की क्रियात्मक समावयवता है जिसमें दोनों समावयवी साम्य अवस्था में होते हैं तथा सरलता से एक-दूसरे में परिवर्तित हो जाते हैं। इस प्रकार की समावयवता तब उत्पन्न होती है। जब हाइड्रोजन या एल्किल समूह द्विबंध या त्रिबंध के दोनों तरफ दोलन करता है।
द्विक प्रणाली:
हाइड्रोजन का दोलन दो बहुसंयोजी परमाणु के मध्य होता है।
![]()
त्रिक प्रणाली – हाइड्रोजन का दोलन तीन बहुसंयोजी परमाणुओं के मध्य होता है।

प्रश्न 25.
निम्नलिखित यौगिकों के आबंध-रेखा-सूत्र लिखिएआइसोप्रोपिल ऐल्कोहॉल, 2, 3 – डाइमेथिल ब्यूटेनल, हेप्टेन – 4 – ओन।
उत्तर:
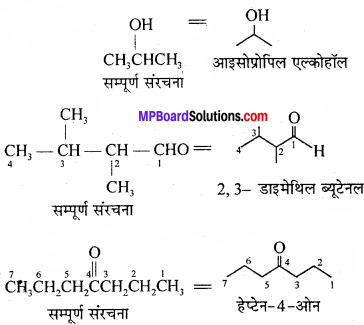
प्रश्न 26.
प्रेरणिक प्रभाव किसे कहते हैं ? इसके क्या उपयोग हैं ?
उत्तर:
जब सहसंयोजी बंध दो भिन्न तत्वों के परमाणुओं के मध्य बनता है तो साझे के इलेक्ट्रॉन दोनों परमाणुओं या नाभिकों के मध्य में न रहकर अत्यधिक ऋण विद्युती तत्व की ओर विस्थापित हो जाता है जिससे अधिक ऋण विद्युती समूह पर आंशिक ऋण आवेश तथा कम ऋण विद्युती समूह पर आंशिक धन आवेश आ जाता है। इस पर σ बंध के इलेक्ट्रॉनों का अधिक ऋण विद्युती समूह की तरफ विस्थापन प्रेरणिक प्रभाव कहलाता है। परमाणुओं की श्रृंखला में ध्रुवीय सहसंयोजक बंध की उपस्थिति के कारण इलेक्ट्रॉन विस्थापन प्रक्रिया प्रेरणिक प्रभाव कहलाता है। प्रेरणिक प्रभाव को बीच में बाणान युक्त डैश से दर्शाते हैं।
![]()
प्रेरणिक प्रभाव के प्रकार –
1.ऋणात्मक प्रेरणिक प्रभाव – वे परमाणु या समूह जो हाइड्रोजन की तुलना में अधिक ऋण विद्युती होते हैं इलेक्ट्रॉन आकर्षी या इलेक्ट्रॉन ग्राही समूह होते हैं। इनका प्रेरणिक प्रभाव ऋणात्मक प्रेरणिक प्रभाव कहलाता है।
+NR3 > \(\stackrel{+}{\mathrm{N}} \mathrm{R}_{2}\) > – \(\stackrel{+}{\mathrm{N}} \mathrm{H}_{3}\), > – NO3 > – SO2R> – CN > – COOH > – F> – Cl> – Br> – I> – OH> – C6H5.
धनात्मक प्रेरणिक प्रभाव:
ऐसे परमाणु जिनकी इलेक्ट्रॉन बंधुता हाइड्रोजन की तुलना में कम होती है इलेक्ट्रॉन निर्मोची कहलाता है। ये धनात्मक प्रेरणिक प्रभाव दर्शाते हैं।
O–>COO–>(CH3)2C > (CH3)2 CH > CH3 CH2 > CH3H .
अनुप्रयोग:
- वसीय अम्लों की प्रबलता की तुलना
- एमीनों के क्षारकीय गुण
- द्विध्रुव आघूर्ण की उपस्थिति।
प्रश्न 27.
निम्नलिखित यौगिकों के IUPAC नाम लिखिए –
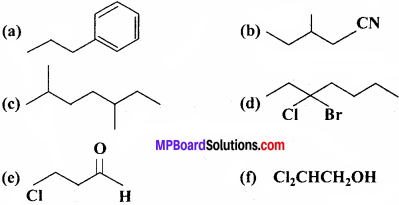
उत्तर:
प्रश्न 28.
इलेक्ट्रोमेरिक प्रभाव क्या है ? इस पर संक्षिप्त टिप्पणी लिखिये।
उत्तर:
यह एक अस्थायी प्रभाव है जो अभिक्रिया के समय केवल किसी अभिकर्मक की उपस्थिति में कार्य करता है। किसी आक्रमणकारी समूह की उपस्थिति में 1 बंध के इलेक्ट्रॉनों का पूर्ण रूप से अधिक ऋण विद्युती समूह की ओर होने वाला विस्थापन इलेक्ट्रोमेरिक प्रभाव कहलाता है। लेकिन जैसे ही आक्रमणकारी समूह को हटाया जाता है। अणु वापिस अपनी मूल स्थिति में आ जाता है। इलेक्ट्रोमेरिक प्रभाव को
![]()
एक मुड़े हुये तीर द्वारा व्यक्त करते हैं। जो उस स्थान से शुरू होता है जहाँ से इलेक्ट्रॉन जाते हैं और उस स्थान पर समाप्त होता है जहाँ पर इलेक्ट्रॉन आते हैं।
धनात्मक इलेक्ट्रोमेरिक प्रभाव:
इसमें 7 इलेक्ट्रॉन युग्म का स्थानान्तरण अणु की मुख्य संरचना के किसी एक छोर पर स्थित परमाणु से अणु के मुख्य भाग की ओर होता है।
उदाहरण – F, CI, Br, I,- 0 -, NR2,NR
ऋणात्मक इलेक्ट्रोमेरिक प्रभाव:
इलेक्ट्रॉन युग्म का स्थानान्तरण अणु की मुख्य संरचना से बाहर की ओर होता है।
उदाहरण – = N, = O = CR2 = S इत्यादि।
अनुप्रयोग –
- एल्कीन या एल्काइन पर हैलोजन की योगात्मक अभिक्रिया।
- कार्बोनिक यौगिकों की नाभिकस्नेही योगात्मक अभिक्रिया।
प्रश्न 29.
प्रेरणिक प्रभाव तथा इलेक्ट्रोमेरिक प्रभाव में अंतर लिखिए।
उत्तर:
प्रेरणिक प्रभाव तथा इलेक्ट्रोमेरिक प्रभाव में अंतर –
प्रेरणिक प्रभाव:
- यह एक स्थायी प्रभाव है।
- यह प्रभाव σ बंध के इलेक्ट्रॉनों के विस्थापन के कारण उत्पन्न होता है।
- आंशिक धन आवेश तथा आंशिक ऋण आवेश उत्पन्न होता है।
- इसके कारण प्रतिस्थापन अभिक्रिया होती है।
- अणु में सदैव उपस्थित रहता है।
इलेक्ट्रोमेरिक प्रभाव:
- यह एक अस्थायी प्रभाव है।
- यह प्रभाव π बंध के इलेक्ट्रॉनों के विस्थापन के कारण उत्पन्न होता है।
- पूर्ण धन आवेश तथा पूर्ण ऋण आवेश होता है।
- इसके कारण योगात्मक अभिक्रियायें होती हैं।
- यह प्रभाव अभिक्रिया के दौरान आक्रमणकारी समूह की उपस्थिति में उत्पन्न होता है।
![]()
प्रश्न 30.
क्रियात्मक समूह उपस्थित होने पर यौगिकों के नामकरण करने के नियम को उदाहरण सहित समझाइये।
उत्तर:
नामकरण के नियम –
- उस कार्बन श्रृंखला का चयन मुख्य श्रृंखला के रूप में करते हैं जिसमें क्रियात्मक समूह उपस्थित हों।
- यदि क्रियात्मक समूह में कार्बन उपस्थित हो तो उसे मुख्य श्रृंखला में गिना जाता है।
- श्रृंखला का क्रमांकन उस सिरे से प्रारम्भ करते हैं जहाँ से क्रियात्मक समूह सिरे के ज्यादा पास है।
- नामकरण करते समय पहले प्रतिस्थापी समूह का नाम लिखा जाता है बाद में मुख्य क्रियात्मक समूह का।
- यदि शृंखला में एक से अधिक क्रियात्मक समूह उपस्थित हो तो वरीयता के आधार पर क्रियात्मक समूह का चयन किया जाता है। फिर प्रतिस्थापी समूह के नाम से पहले मुख्य क्रियात्मक समूह को छोड़कर अन्य क्रियात्मक समूह की स्थिति दर्शाकर उनके नाम लिखते हैं।
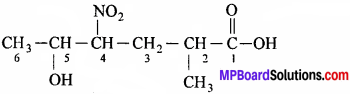
प्रश्न 31.
निम्नलिखित यौगिकों के IUPAC नाम व सूत्र दीजिये
- आयोडोफॉर्म
- सिरका
- फॉर्मिक अम्ल
- मार्शगैस
- एसीटोन
- ग्लाइकॉल
- डाईमेथिल ईथर
- फॉर्मेल्डिहाइड
- मेथिल सायनाइड।
उत्तर:
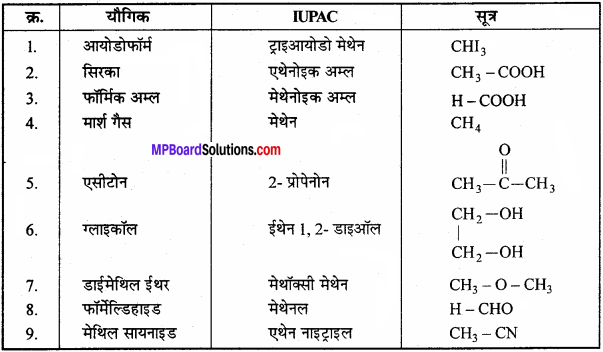
प्रश्न 32.
निम्नलिखित यौगिकों के संरचना सूत्र लिखिए –
- 3,3,-डाइमिथाइलपेण्टीन
- 4-मेथिलहेक्सेन-2ऑल
- 1,2डाइब्रोमोएथेन
- नाइट्रोमेथेन
- 4-मेथिल-3 हाइड्रॉक्सी पेन्टेन।
उत्तर:
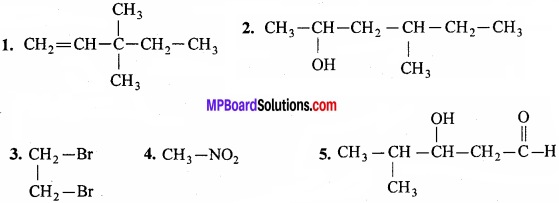
प्रश्न 33.
एलीफैटिक तथा एरोमैटिक यौगिक में अंतर लिखिये।
उत्तर:
एलीफैटिक तथा एरोमैटिक यौगिक में अंतर –
एलीफैटिक यौगिक:
- ये खुली श्रृंखला वाले यौगिक होते हैं।
- इनमें प्रायः C – C बंध पाया जाता है।
- ये अधिक क्रियाशील होते हैं।
- हैलोजनीकरण, नाइट्रीकरण, सल्फोनीकरण सरलता से नहीं होता।
- इनकी दहन ऊष्मा अधिक होती है।
- इनके – OH मूलक उदासीन होते हैं।
- इनके मूलक क्षारीय होते हैं।
एरोमैटिक यौगिक:
- ये बंद श्रृंखला वाले यौगिक होते हैं।
- इनके चक्र में एकान्तर क्रम में एकल व द्विबंध होते हैं।
- ये कम क्रियाशील होते हैं।
- हैलोजनीकरण, नाइट्रीकरण, सल्फोनीकरण सरलता से होता है।
- इनकी दहन ऊष्मा कम होती है।
- इनके हाइड्रॉक्सी यौगिक अम्लीय गुण दर्शाते हैं।
- इनके मूलक अम्लीय होते हैं।
![]()
प्रश्न 34.
अनुनाद प्रभाव क्या है ? इसके अनुप्रयोग लिखिये।
उत्तर:
यह प्रभाव संयुग्मी निकाय जिनमें एकल बंध व द्विबंध एकान्तर क्रम में उपस्थित हो उनमें होता है। अनुनाद के कारण निकाय के किसी एक भाग से इलेक्ट्रॉनों का प्रवाह दूसरे भाग की ओर होता है जिससे अलगअलग इलेक्ट्रॉन घनत्व के केन्द्र बन जाते हैं, इस घटना को अनुनाद प्रभाव या मेसोमेरिक प्रभाव कहते हैं। यह एक स्थायी प्रभाव है।
ऋणात्मक मेसोमेरिक प्रभाव:
इलेक्ट्रॉन युग्म का स्थानान्तरण जब परमाणु या समूह की ओर होता है तो इसे – M प्रभाव कहते हैं।
उदाहरण – – NO2, – CHO, – SO3H, > C = O.
धनात्मक मेसोमेरिक प्रभाव-इलेक्ट्रॉन युग्म का स्थानान्तरण जब परमाणु या समूह से दूर की ओर होता है तो उसे +M प्रभाव कहते हैं।
उदाहरण – – OH – OR, – SH, – SR, – NH2, – Cl, – Br
अनुप्रयोग –
- बेंजीन की संरचना निर्धारण में।
- द्विध्रुव आघूर्ण की व्याख्या में।
- अम्ल व क्षार की सामर्थ्य का स्पष्टीकरण।
- संयुग्मी योगात्मक अभिक्रिया।
प्रश्न 35.
प्रतिस्थापन अभिक्रिया किसे कहते हैं ? उदाहरण सहित समझाइये।
उत्तर:
वे अभिक्रियाएँ जिनमें अभिकारक अणु के किसी परमाणु या समूह का अभिकर्मक के किसी परमाणु या समूह द्वारा प्रतिस्थापन होता है, उसे प्रतिस्थापन अभिक्रिया (Substitution reaction) कहते हैं।
उदाहरण –
![]()
इसमें मीथेन के H परमाणु का CI परमाणु द्वारा प्रतिस्थापन हुआ है।
(ii) CH3CH2 – OH + PCl5 → CH3CH2Cl + POCl3 + HCl
इस अभिक्रिया में एल्कोहॉल का – OH समूह – Cl के द्वारा प्रतिस्थापित हुआ है।
कार्बनिक रसायन : कुछ आधारभूत सिद्धान्त तथा तकनीकें दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
(a) IUPAC नामकरण संबंधी नियम क्या है ?
(b) IUPAC नाम दिया हो तो संरचना सूत्र किस प्रकार लिखा जाता है ?
उत्तर:
(a) IUPAC नामकरण के नियम – किसी यौगिक का IUPAC नामकरण निम्नलिखित नियमों के अनुसार करते हैं –
- सर्वाधिक लम्बी कार्बन श्रृंखला का चयन
- वरीय कार्बन श्रृंखला का चयन
- श्रृंखला में कार्बन परमाणुओं का क्रमांकन
- प्रतिस्थापियों की स्थितियों का न्यूनतम योग नियम
- प्रतिस्थापियों का अंग्रेजी वर्णमाला क्रम में नामोल्लेख
- प्रतिस्थापियों के नामों की संख्या सूचक पूर्वलग्न
- सम-स्थित प्रतिस्थापियों का स्थान क्रमांकन
- यौगिक में क्रियात्मक समूह, द्विबंध या त्रिबंध उपस्थित है तो प्रतिस्थापियों की तुलना में वरीयता।
(b) संरचना सूत्र लिखना – कार्बनिक यौगिक के IUPAC नाम ज्ञात होने पर संरचना सूत्र लिखते समय निम्न बिन्दुओं का ध्यान में रखा जाना आवश्यक है –
- सर्वप्रथम कार्बनिक यौगिक के IUPAC नाम से मुख्य श्रृंखला लिखते हैं।
- श्रृंखला के किसी भी सिरे से कार्बन श्रृंखला का क्रमांकन करते हैं।
- अनुलग्न के आधार पर मुख्य क्रियात्मक समूह को उसकी स्थिति के अनुसार दर्शाते हैं।
- यदि ene तथा yne शब्द का प्रयोग हुआ है तो स्थिति के अनुसार द्विबंध और त्रिबंध को दर्शाते हैं।
- पूर्वलग्न के आधार पर अन्य क्रियात्मक समूह को उनकी स्थिति के आधार पर दर्शाते हैं।
- कार्बन की संयोजकता को पूर्ण करने के लिये हाइड्रोजन जोड़ते हैं।

प्रश्न 2.
कार्बनिक यौगिक में उपस्थित नाइट्रोज न के आकलन की जेल्डॉल विधि का वर्णन निम्न शीर्षक में कीजिए –
1. सिद्धांत
2. चित्र
3. रासायनिक समीकरण
4. अवलोकन तथा गणना।
उत्तर:
जेल्डॉल विधि का सिद्धांत:
जब नाइट्रोजन युक्त कार्बनिक पदार्थ की ज्ञात मात्रा लेकर उसे सान्द्र H2SO4 के साथ गर्म करते हैं तो कार्बनिक यौगिक में उपस्थित नाइट्रोजन, अमोनियम सल्फेट में परिवर्तित हो जाती है। इसे NaOH के साथ गर्म करने पर NH3 गैस बनती है। इस NH3 गैस को मानक अम्ल जैसे H2SO4 के ज्ञात आयतन में अवशोषित कर लेते हैं । प्रयोग के पश्चात् H2SO4 का मानक क्षार के साथ अनुमापन कर अमोनिया की बची मात्रा का परिकलन कर लेते हैं। इस मात्रा से कार्बनिक पदार्थ में नाइट्रोजन की % मात्रा को ज्ञात किया जा सकता है।
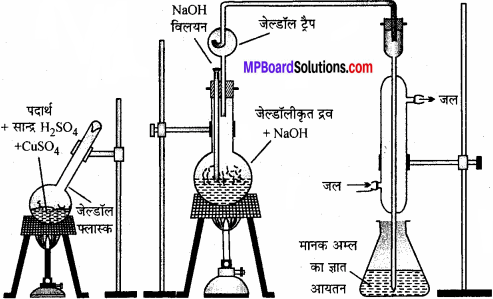
अवलोकन एवं गणना – माना कि:
- कार्बनिक यौगिक का द्रव्यमान = W gm
- अमोनिया द्वारा उदासीन किये गये अम्ल का आयतन = Vml
- अमोनिया द्वारा उदासीन किये गये अम्ल की नार्मलता = N
N नार्मल अम्ल के Vml = N नार्मल अमोनिया में Vml
∴ IN अमोनिया विलयन के 1000 ml में = 17 gm NH3 है या 14 gm N2 है।
1 ….. “….. Vml में नाइट्रोजन = \(\frac { 14 }{ 1000 }\) × Vgm
∴ N नार्मल अमोनिया विलयन के Vml में नाइट्रोजन = \(\frac { 14 }{ 1000 }\) × V × Ngm
Wgm पदार्थ में =\(\frac { 14 × V × N }{ 1000 }\) gm नाइट्रोजन है।
∴ ….. “….. 100 gm = \(\frac { 14 × V × N }{ 1000 }\) × \(\frac { 100 }{ W }\)
नाइट्रोजन का % = \(\frac { 14 × V × N }{ W }\)
![]()
प्रश्न 3.
यौगिकों के आणविक द्रव्यमान ज्ञात करने की विक्टर मेयर विधि को चित्र सहित समझाइये।
उत्तर:
सिद्धांत:
इस विधि द्वारा वाष्पशील पदार्थों के आणविक द्रव्यमान ज्ञात किये जा सकते हैं। किसी वाष्पशील यौगिक की ज्ञात मात्रा को विक्टर नली में वाष्पित करने पर यौगिक की वाष्प अपने आयतन के बराबर वायु को विस्थापित करती है। वाष्पित वायु का आयतन तथा कमरे के ताप को नोट कर लेते हैं तथा गैस समीकरण की सहायता से इस आयतन को S.T.P. पर शुष्क वायु के आयतन में बदल लेते हैं। इस आयतन तथा यौगिक के द्रव्यमान से यौगिक की वाष्प घनत्व तथा आणविक द्रव्यमान की गणना की जा सकती है।
उपकरण:
- ताँबे का बना हुआ बाहरी जैकेट
- विक्टर मेयर नली जिसमें काँच की पार्श्व नली लगी होती है
- अंशाकित सिलेण्डर
- हॉफमैन बॉटल।
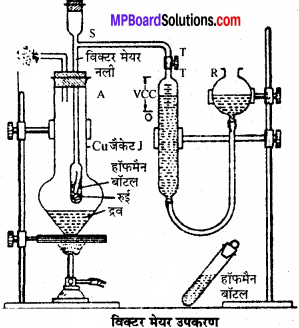
गणना:
माना कि कार्बनिक यौगिक का द्रव्यमान = Wgm, विस्थापित वायु का आयतन = Vml, वायुमण्डलीय दाब = P mm, कमरे का ताप = t°C या t + 273 K, t°C पर जलीय तनाव = t, शुष्क वायु का दाब = p – f, S. T. P. पर वाष्प का आयतन
प्रायोगिक अवस्था में:
P1 = p – f, V1 = Vml, T1 = t + 273
S. T. P. पर – P2 = 760, V2 = ? T2 = 273 K

S.T.P. पर V2 ml वाष्प W gm पदार्थ से प्राप्त होती है।

प्रश्न 4.
कार्बनिक यौगिक के शोधन की स्तम्भ क्रोमैटोग्राफी विधि को समझाइये।
उत्तर:
सिद्धांत:
किसी मिश्रण के विभिन्न अवयवों को किसी अधिशोषक पर अधिशोषित होने की क्षमता या शक्ति में भिन्नता होती है। अधिशोषण के आधार पर किसी मिश्रण में उपस्थित अवयवों को पृथक् करने –
(1) अधिशोषक स्तम्भ बनाना:
ब्यूरेट के समान एक लंबी नली में अधिशोषक पदार्थ जैसे – एलूमिना, जिप्सम, सिलिका जैल में से किसी एक का उचित विलायक में पेस्ट बनाकर नली में भर देते हैं। जब अधिशोषक जम जाता है तब विलायक को थोड़ी देर के लिये बहने दिया जाता है। पेस्ट बनाते समय उसी विलायक का प्रयोग करते हैं जिसमें पृथक्करण किये जाने वाले मिश्रण को विलेय किया जाता है।
(2) अधिशोषण प्रक्रम:
जिस पदार्थ या मिश्रण को अधिशोषित करना होता है उसे विलायक की अल्प मात्रा में विलेय करते हैं। इसके लिये अध्रुवीय विलायक जैसे बेंजीन, ईथर इत्यादि का उपयोग करते हैं। इस विलयन को अधिशोषक स्तम्भ से गुजरने दिया जाता है। मिश्रण का वह अवयव जो अधिक प्रबलता से अधिशोषित होता है वह इस स्तम्भ में सबसे ऊपर एक बैंड बनाता है तथा जो घटक सबसे कम अधिशोषित होता है वह सबसे बाद में बैंड बनाता है। इस प्रकार विभिन्न घटक इस अधिशोषक स्तम्भ में विभिन्न स्थानों पर अधिशोषित होकर भिन्नभिन्न रंगों की पट्टियाँ बनाते हैं।
निक्षालन:
इस पद में पदार्थ का अधिशोषण हो चुकने के बाद निक्षालक विलायक स्तम्भ में डालकर धीरे-धीरे नीचे की ओर बहने देते हैं तथा बहकर निकले हुए द्रव विलयनों को इकट्ठा करते जाते हैं । विलायकों को बढ़ती हुई ध्रुवता के क्रम में प्रयुक्त करते हैं। ये विलायक एक के बाद एक क्रम में डाले जाते हैं।
वह अवयव जो सबसे कम अधिशोषित होता है वह सबसे कम ध्रुवता वाले विलायक द्वारा निक्षालित होता है तथा जो सबसे अधिक अधिशोषित होता है वह अधिक ध्रुवता वाले विलायक द्वारा निक्षालित होता है। फिर इन विलायकों से इन अवयवों को आसवन विधि द्वारा पृथक् कर लिया जाता है।
![]()
प्रश्न 5.
कार्बनिक क्षार के अणुभार ज्ञात करने की क्लोरोप्लेटिनेट विधि का वर्णन कीजिए।
उत्तर:
सिद्धांत:
क्लोरोप्लेटिनिक अम्ल से कार्बनिक क्षार संयोग करके सामान्य सूत्र B2H2PtCl6 के अघुलनशील पदार्थ बनाते हैं। B क्षार के तुल्यांक को दर्शाता है। इस प्लेटिनम लवण में ज्वलन के पश्चात् धात्विक प्लेटीनम प्राप्त होता है।
![]()
प्लेटीनम लवण एवं धात्विक प्लेटीनम दोनों के अलग-अलग भार होने पर क्षार का अणुभार ज्ञात कर लेते हैं।
विधि:
कार्बनिक क्षार को पहले तनु HCl से अभिकृत करके विलेय हाइड्रोक्लोराइड प्राप्त कर लिया जाता है। इसमें प्लेटीनिक क्लोराइड को मिलाकर क्षार के लवण को क्लोरोप्लेटीनेट के रूप में प्राप्त कर लेते हैं। इसे धोकर सुखा लेते हैं। ज्ञात मात्रा को प्लेटीनम क्रूसीबल में लेकर गर्म करने के पश्चात् प्लेटीनम को क्रूसीबल में शेष पदार्थ के रूप में प्राप्त कर लेते हैं। इससे क्षार का तुल्यांक भार ज्ञात कर लेते हैं।
गणना:
क्षार का तुल्यांक भार =E
प्लेटीनम लवण का भार = Wgm
प्लेटीनम का भार = xgm
B2H2PtCl6 का अणुभार = 2E + 2 + 195 + 213 = 2 E + 410

प्रश्न 6.
कार्बनिक यौगिक में नाइट्रोजन निर्धारण की ड्यूमा की विधि का सिद्धांत बताकर विवरण दीजिये।
उत्तर:
ड्यूमा विधि:
किसी नाइट्रोजन युक्त कार्बनिक पदार्थ की निश्चित मात्रा को क्यूप्रिक ऑक्साइड के साथ CO2 के वायुमण्डल में दहन कराने पर C, H, S क्रमश: CO2H2O व SO2 में ऑक्सीकृत हो जाते हैं। नाइट्रोजन मुक्त अवस्था में प्राप्त होती है तथा साथ में नाइट्रोजन के ऑक्साइड कुछ मात्रा में बनते हैं।
C + 2CuO → CO2 + 2Cu
2H + CuO → H2O + Cu
नाइट्रोजन + CuO → N + नाइट्रोजन के ऑक्साइड
गैसीय मिश्रण को Cu की जाली पर प्रवाहित करने पर नाइट्रोजन के ऑक्साइड नाइट्रोजन में अपचयित हो जाते हैं। मुक्त नाइट्रोजन को HOH से भरे नाइट्रोमीटर में एकत्रित कर लेते हैं। HOH विलयन CO2, SO2, व H2O को अवशोषित कर लेती है। नाइट्रोमीटर में वायुमण्डलीय दाब व ताप पर N2 का आयतन ज्ञात कर इसे S.T.P. में परिवर्तित करके उससे नाइट्रोजन की प्रतिशत मात्रा ज्ञात कर लेते हैं।
अवलोकन व गणना:
कार्बनिक यौगिक का द्रव्यमान = Wgm, नाइट्रोजन का आयतन = Vml, कमरे का ताप = t°C, वायुमण्डल का दाब = p mm, t°C ताप पर जलीय तनाव = f.
सामान्य ताप पर:
P1 = (p – f), V1 = Vml, T1 = t + 273
S. T. P. पर – P2 = 760 mm, V2 = ? T2 = 0 + 273,

22, 400 ml S.T.P. पर N2 का द्रव्यमान 28gm है।